Guselkumab-治療克隆氏症之潛力藥物
曾子維、施承典
大仁科技大學藥學系
摘要
克隆氏症(Crohn's disease,
CD)是一種慢性反覆發炎的腸道疾病,致病機轉尚未明朗,可能由遺傳、飲食,或其他環境因素誘發。通常造成腹痛、頻繁腹瀉、甚至直腸出血,目前的藥物治療只能緩解疾病而無法徹底治癒。本文將介紹治療克隆氏症的潛力藥物guselkumab,為全人類IgG1
lambda單株抗體(monoclonal
antibody),是第一種被美國FDA批准的IL-23
p19次單元抑制劑。2016年,嬌生公司旗下的楊森藥廠研發出此藥物,2017年獲得美國FDA核可,用於治療斑塊型乾癬(plaque
psoriasis),2018年獲准在日本用於治療斑塊型乾癬,2020年,美國FDA核可為第一種用於治療乾癬性關節炎(psoriatic
arthritis)的IL-23抑制劑。近年研究發現透過IL-23途徑可用來治療CD,目前已完成二期試驗,三期試驗由楊森藥廠進行中,並積極招募受試者。相較於以往藥物,guselkumab對生物製劑不耐受之患者極具潛力能有更好的療效及安全性,期望能延緩病程和減緩症狀,讓病人有更多選擇。
關鍵字: 克隆氏症、Crohn's disease、單株抗體、monoclonal
antibody、Guselkumab、IL-23
壹、前言
克隆氏症(Crohn's disease)屬於罕見的慢性發炎腸道疾病(inflammatory
bowel disease, IBD),目前致病機轉尚未明朗,為一種受到遺傳及環境因子交互影響的免疫相關疾病。根據健保資料庫,台灣每十萬人僅有3-4名患者,然而近年來有逐步上升的趨勢1。患者的所有消化道部位(口腔至肛門)均有可能發生發炎反應,症狀較潰瘍性結腸炎(ulcerative
colitis)更為持久,腹瀉與腹痛也更強烈,屬於跳躍性病灶,且影響部位較深,會造成整層腸壁的發炎,甚至擴及腹膜,嚴重時會導致腸穿孔或瘻管等併發症1。目前使用抗發炎藥物5-ASA(5-aminosalicylic
acid)、類固醇、免疫調節藥物(methotrexate、azathioprine)來治療,然而,這些藥物在臨床緩解方面往往是無效的,有些甚至具有毒性2。若為中至重度的克隆氏症患者,則考慮使用生物製劑腫瘤壞死因子-α抑制劑(TNF-α
inhibitor)或細胞激素抗體(IL-12/IL-23
antibody)等來治療1。近年來,以單株抗體為大宗的生物製劑已成為治療克隆氏症的重要藥物,Guselkumab是一種治療克隆氏症的單株抗體(monoclonal
antibody),本文將介紹guselkumab現況及目前臨床治療資訊。
貳、單株抗體Guselkumab的現況與作用機制
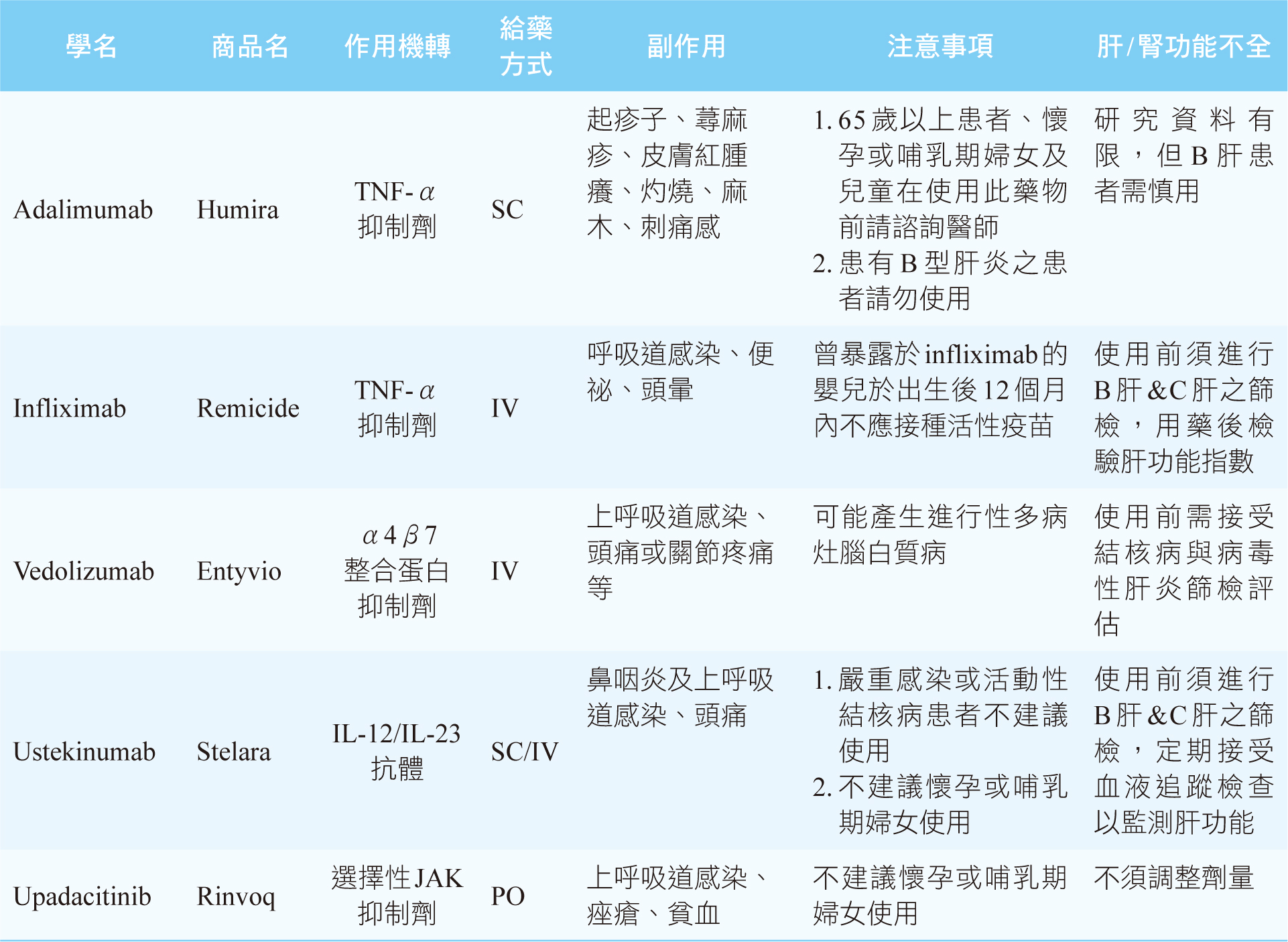
過去常用一種單株抗體的生物製劑TNF-α inhibitor如adalimumab、infliximab、vedolizumab等來治療較嚴重的克隆氏症或用來控制長期發炎,也使用ustekinumab(IL-12/IL-23
antibody)來治療,目前臨床新藥亦包含2023年被美國FDA核准的小分子口服免疫調節藥upadacitinib3,如表一所示。相較於傳統藥物如5-ASA、類固醇、免疫調節藥來說,生物製劑的專一性及安全性較高,療效更穩定2,副作用也較低,然而價格昂貴且為注射劑型,使用方式較不便4。
其中,guselkumab(商品名Tremfya)是一種全人類基因重組的IgG1
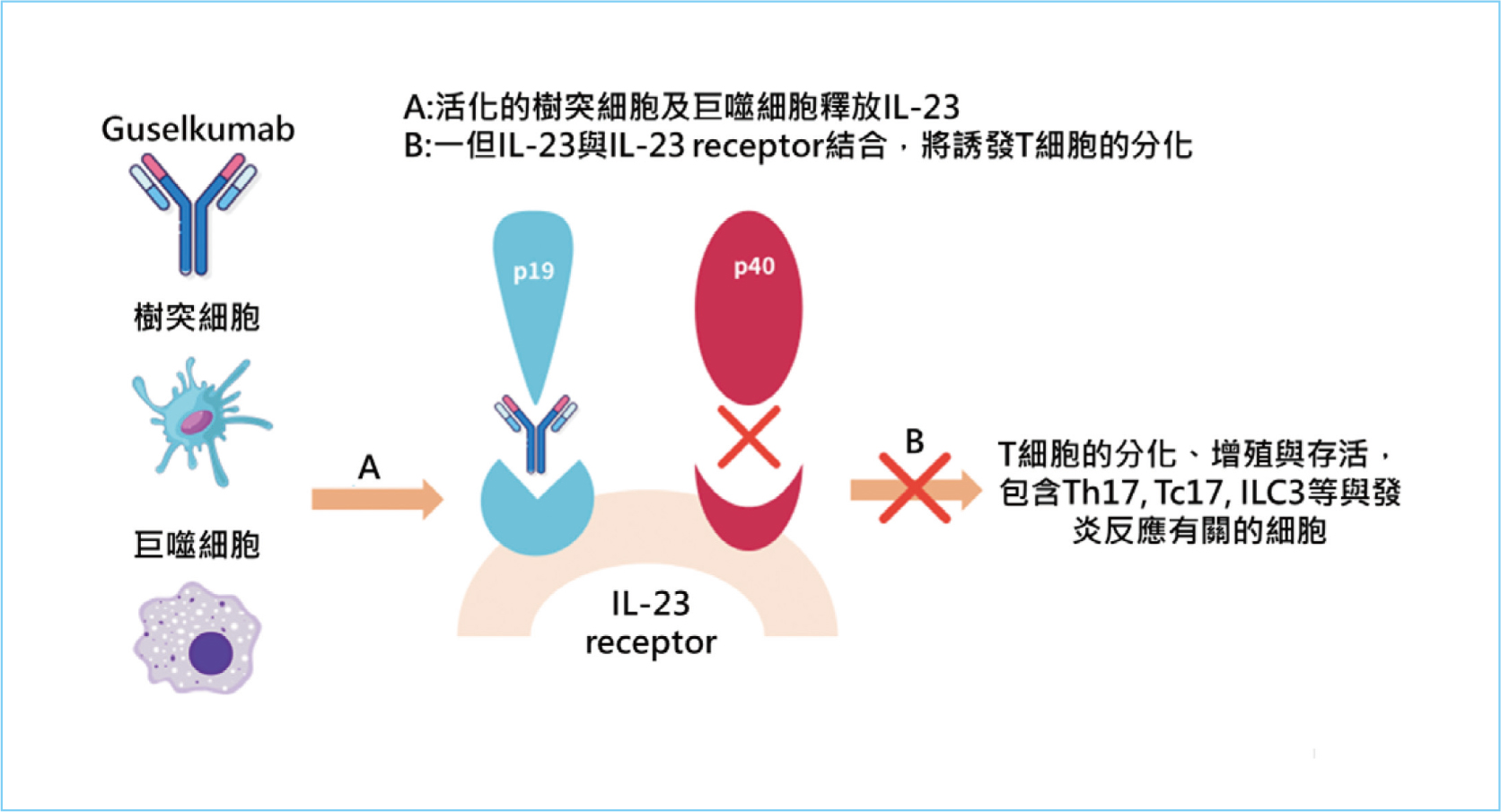
lambda單株抗體,它是第一種選擇性細胞激素IL-23的p19次單元抑制劑。IL-23對維持腸道發炎反應很重要2,由p40與p19次單元組成,其中p40次單元與IL-12共享,且IL-12則被認為參與了腸道發炎反應的啟動2,由p40與p35次單元組成。非選擇性的IL-23抑制劑,例如ustekinumab,與IL-23及IL-12的p40次單元結合,阻斷了IL-23及IL-12的訊息傳遞路徑。然而,選擇性的IL-23抑制劑,例如guselkumab,僅與IL-23的p19次單元結合,只抑制了IL-23媒介的訊息傳遞路徑,如圖一所示,以達到抑制腸道發炎反應的作用5,6。
Guselkumab目前已被核准用於中至重度的斑塊型乾癬(plaque
psoriasis)的治療7。在一項與乾癬有關的研究指出,與IL-12/IL-23途徑相比,IL-23途徑的研究顯示出更大的有效性8,因此在IBD中也可能出現類似的結果。臨床研究也指出IL-23/Th17(Th:輔助T-細胞)途徑對於克隆氏症的重要性9,10。而腸道發炎反應與促炎性細胞因子如白介素IL及T細胞有關,活化的樹突細胞與巨噬細胞釋放IL-23,一但IL-23與自身的接受器結合後,將誘發一系列T細胞的分化、增殖與存活,包含Th17、Tc17、ILC3等與發炎反應有關的細胞,這些細胞反應造成腸道微生物的發炎與變化9。在IBD患者的腸黏膜、血漿和血清中也發現IL-23等細胞激素有上升的現象11。
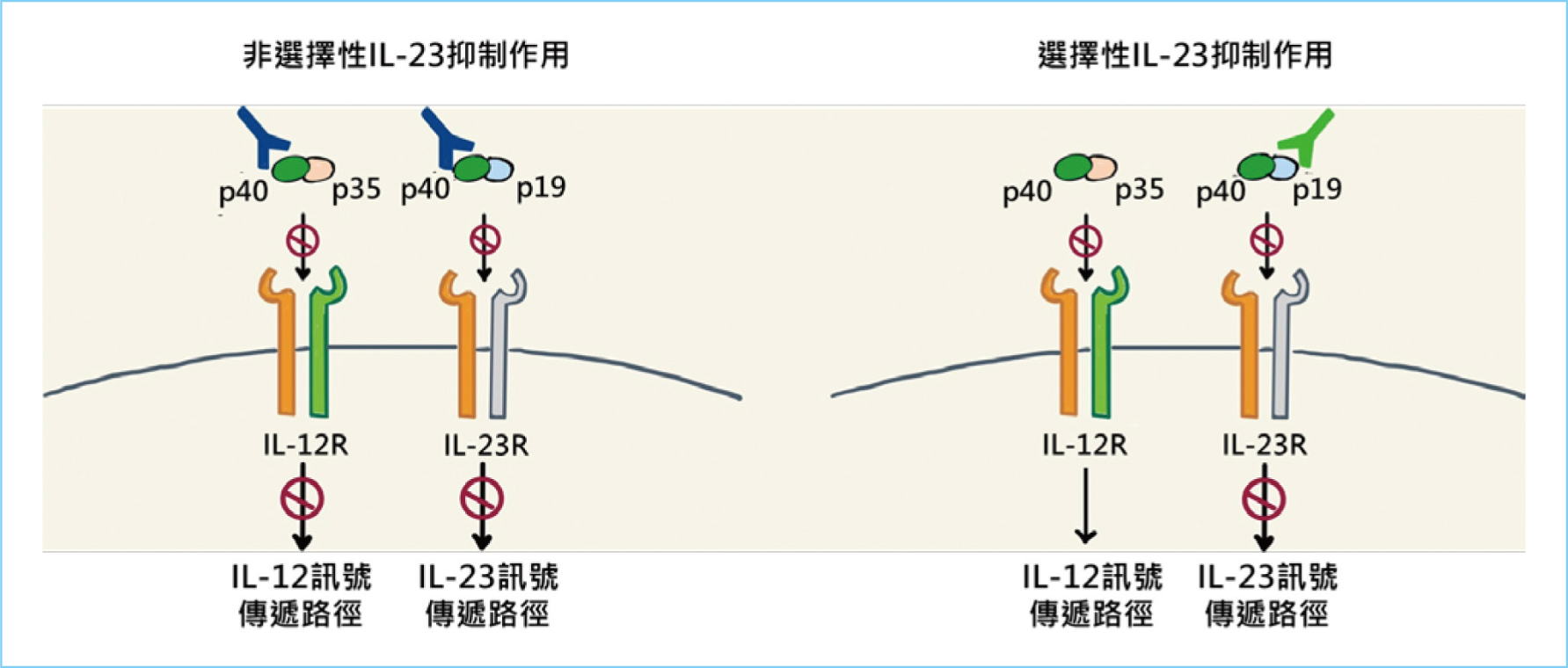
圖一 非選擇性IL-23抑制劑與選擇性IL-23抑制劑的比較6
因此,當guselkumab與IL-23的p19次單元結合時,阻斷IL-23與IL-23
接受器的交互作用,IL-23媒介的訊號傳遞路徑以及促發炎細胞激素的釋放也被阻斷,如圖二所示5,7,12。
目前研究假設IL-23在乾癬的作用機轉與發炎性腸道疾病相似,因此相較於IL-12/IL-23訊號傳遞路徑來說,更專一的IL-23訊號傳遞可能會有較佳的臨床益處5,在未來的研究中將進行更徹底的評估。
參、臨床療效與安全性5,13
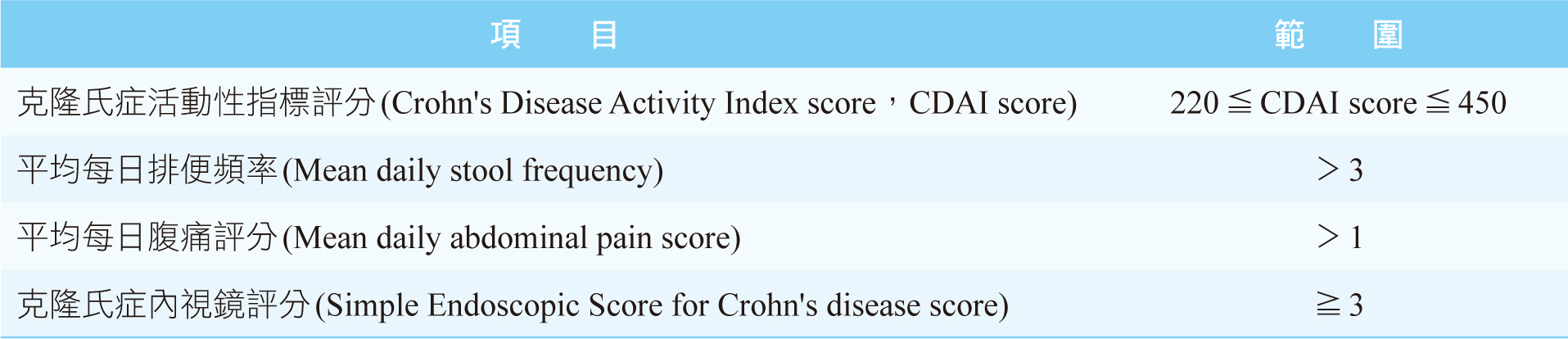
目前由嬌生公司旗下的楊森藥廠主導之第三期臨床試驗正在進行中,已結束的GALAXI-1第二期臨床試驗設計為雙盲、隨機、安慰劑對照組,在32個國家招募了309名受試者,平均年齡為38.8歲,平均克隆氏症病程為8.8年,患有中至重度活動性克隆氏症且病程大於三個月,活動性克隆氏症之定義1,5,如表二所示。大約有一半的受試者對先前的常規治療反應不佳,對下列治療方法中的一種或多種失去反應或不耐受,如口服皮質激素(包含budesonide及beclomethasone
dipropionate)與免疫調節藥物(methotrexate、azathioprine、6-mercaptopurine)。在某些受試者中,甚至出現皮質激素依賴性症狀,一但停用皮質激素,克隆氏症症狀即復發。
表二 活動性克隆氏症之定義1,5
在試驗中,受試者以1:1:1:1:1的比例分為五組,其中三組分別接受不同劑量guselkumab靜脈注射,分別為200
mg、600 mg及1200 mg,在第0、4、8週均須注射一次。另一組在第0週接受6
mg/kg的ustekinumab靜脈注射,並在第八週皮下注射90
mg作為對照組。最後一組則為安慰劑組。
試驗為期三個月以上,主要終點是克隆氏症活動性指標評分(Crohn's Disease
Activity Index score, CDAI
score)從尚未給藥前(起始值)到第十二週的變化。次要終點有五項,分別是第十二週的臨床緩解(clinical
remission)、臨床反應(clinical
response)、病患自述結果(patient reported outcome-2,
PRO-2)、內視鏡反應(endoscopic
response)、臨床生物標誌物反應(clinical-biomarker
response)。用主要終點及五項次要終點來評估guselkumab對中至重度的克隆氏症患者之有效性及安全性5,13。此外,CDAI
score最高為600分,小於150代表病情緩解,介於220到450之間表示中重度發炎,大於450則為嚴重發炎。計算方式採用數個臨床或檢驗項目,按照加權方式加總後得到總分。例如,每星期中每天稀便與軟便次數的總和以加權值2計算,其他項目也按照類似方式進行加權計算1,5。
在第四週時,觀察到接受不同劑量guselkumab之三個組別的CDAI變化與安慰劑組間存在顯著差異5,雖然仍須考慮樣本量、試驗設計,及評估指標來確定其是否有臨床意義,但這表明了在較短的時間內,藥物已展現出與安慰劑組不同的效果。在第十二週時,試驗達到主要終點,在給予200/600/1200
mg之guselkumab的患者身上觀察到,相較於安慰劑,他們的 CDAI
score與起始值相比有明顯的下降(p<0.05)5,如圖三所示。在次要終點中,guselkumab組之效果均比安慰劑組佳5,13,表明了guselkumab能夠有效控制病症並降低CDAI,彰顯了其臨床療效及意義。
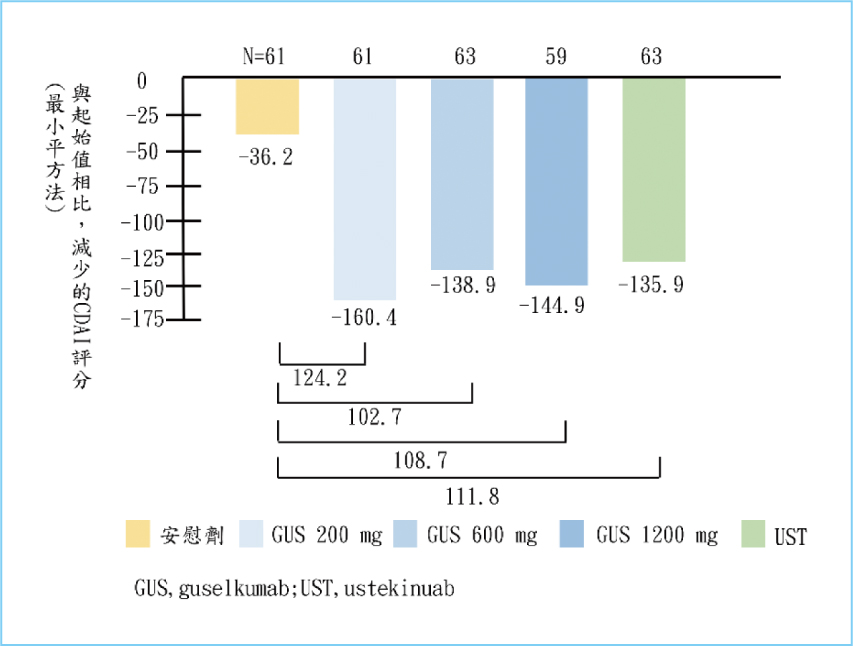
圖三 CDAI score從起始值到第十二週的變化5,13
安全性方面,在第十二週時,各治療組出現一個或更多不良反應的機率相似,安慰劑組有60.0%,guselkumab組佔45.7%,ustekinumab組則是50.7%,不良反應如貧血與上呼吸道感染等,並且出現至少一次嚴重不良反應的機率分別為0.0%、1.4%、1.4%,觀察到guselkumab組出現不良反應的機率低,有較佳的安全性。此外,該項試驗也發現在guselkumab組中,劑量與不良反應沒有明顯的關係。嚴重的過敏性休克(anaphylaxis)、血清病(serum
sickness),或開放性結核病(active
tuberculosis)在12週的試驗內也都沒有發生5。
Guselkumab治療組在達到主要終點及次要終點的比例,均比安慰劑組來的高,對於中至重度活動性克隆氏症患者這類目標人群而言,guselkumab有其治療意義,能夠解決潛在的炎症疾病,病人報告的結果也有所改善5。雖然guselkumab極具潛力能有更好的臨床改善,也具備系統性文獻回顧探討生物製劑用於中至重度克隆氏症之療效與安全性,但缺乏頭對頭試驗(head-to-head
trial)比較哪一種治療對病患最有幫助,以及藥物彼此的差異以及風險,因此臨床上對於的治療方案仍須透過醫病共享決策,由醫師與病患共同討論用藥風險與益處以做決定14。
肆、注意事項15
目前還沒有關於孕婦使用guselkumab的數據,因此與藥物有關的胎兒不良發育風險尚難以釐清。已知人類IgG抗體可穿過胎盤屏障,因此guselkumab可能會從母體傳給發育中的胎兒。在一項結合胚胎發育和產前產後發育的研究中,懷孕的猴子在器官發育期至分娩期,給予每週皮下注射高達50
mg/kg
guselkumab(劑量為人類最大推薦劑量的30倍)。最終,一隻對照組猴子的後代、三隻以每週10
mg/kg的劑量(人類最大推薦劑量的6倍)給藥之猴子的後代,和三隻以每週50
mg/kg劑量給藥之猴子的後代,均發生了新生兒死亡。這些發現的臨床意義尚不清楚,且在出生至6個月的嬰兒沒有觀察到與guselkumab有關之發育的影響。
目前關於guselkumab在人類乳汁中的存在、對哺乳期嬰兒的影響,或對乳汁分泌之影響的數據尚無研究。已知母體的IgG存在於人類乳汁中,但guselkumab在哺乳期猴子的乳汁中卻未被檢測出。
伍、結語
Guselkumab是第一種選擇性IL-23的p19次單元抑制劑,在二期臨床試驗GALAXI-1中,三種劑量的guselkumab均能使中至重度克隆氏症患者得到臨床上的改善,並具備良好的安全性。然而這項研究仍有局限性,試驗只評估了十二週,仍需要長期的數據。此外,由於二期試驗樣本數小,對guselkumab在克隆氏症患者中的療效做出結論的能力受限。日前另外一款治療藥物,第二代JAK(janus
kinase)抑制劑filgotinib的第三期臨床試驗失利,即使二期的臨床數據不錯,但三期沒有在臨床緩解及內視鏡反應達到共同主要療效指標(co-primary
endpoints),且具睪丸毒性,克隆氏症治療藥物的進展仍須仰賴各大製藥公司再研究一段時間來推動。
無論如何,這個為期12週的研究結果進一步證實了以IL-23為標靶,治療克隆氏症的臨床意義。目前嬌生公司旗下的楊森藥廠正在進行評估guselkumab治療克隆氏症之有效性及安全性的三期試驗,期望未來能蒐集更多臨床數據及觀察更長的時間,來驗證guselkumab能達到預期的治療效果。
Guselkumab-A Potential Drug for the Treatment of
Crohn's Disease
Tzu-Wei Tseng, Cheng-Dean Shih
Department of Pharmacy, Tajen University
Abstract
Crohn's disease (CD) is a chronic and recurrent
inflammatory bowel disease, and the pathogenesis
is still unclear. It may be induced by genetics,
diet, or other environmental factors. CD usually
causes abdominal pain, frequent diarrhea, and
even rectal bleeding. Current drug treatments
can only alleviate the symptoms and cannot cure
the disease completely. This article introduces
guselkumab, a potential drug for the treatment
of CD. Guselkumab is a human IgG1 lambda
monoclonal antibody and the first IL-23 p19
subunit inhibitor approved by the US FDA. In
2016, Janssen Pharmaceuticals, a subsidiary of
Johnson & Johnson, developed this drug, which
was approved by the US FDA for the treatment of
plaque psoriasis in 2017 and approved for the
treatment of plaque psoriasis in Japan in 2018.
In 2020, it was approved by the US FDA as the
first IL-23 inhibitor for the treatment of
psoriatic arthritis. In recent years, it has
been found that the IL-23 pathway can be used to
treat CD. Phase 2 trials have been completed,
and phase 3 trials are currently being conducted
by Janssen Pharmaceuticals, actively recruiting
participants. Compared with previous drugs,
guselkumab has the potential to offer enhanced
efficacy and safety for patients who are
intolerant to biologics. It is expected to delay
the course of the disease and alleviate
symptoms, providing more options for patients.
參考資料:
1. 台灣發炎性腸道疾病學會:克隆氏症臨床治療指引
https://www.tsibd.org.tw/news.php?index=106&c1=2
2. Lamb CA, Kennedy NA, Raine T, et al: British
Society of Gastroenterology consensus guidelines
on the management of inflammatory bowel disease
in adults. Gut. 2019;68(Suppl 3):s1-s106.
3. Loftus EV Jr, Panés J, Lacerda AP, et al:
Upadacitinib induction and maintenance therapy
for Crohn's Disease. N Engl J Med.
2023;388(21):1966-1980.
4. 賴怡珊、童玟津:藥物於預防克隆氏症者手術後復發。藥學雜誌2016;32
https://jtp.taiwan-pharma.org.tw/127/021.html
5. Sandborn WJ, D'Haens GR, Reinisch W, et al:
Guselkumab for the treatment of Crohn's Disease:
induction results from the Phase 2 GALAXI-1
study. Gastroenterology.
2022;162(6):1650-1664.e8.
6. Nogueira M, Torres T: Guselkumab for the
treatment of psoriasis-evidence to date. Drugs
Context. 2019;8:212594.
7. 張皓勇、吳俊男、李建瑩:斑塊型乾癬新藥Guselkumab。藥學雜誌2018;34
http://jtp.taiwan-pharma.org.tw/136/011.html
8. Gordon KB, Strober B, Lebwohl M, et al:
Efficacy and safety of risankizumab in
moderate-to-severe plaque psoriasis (UltIMMa-1
and UltIMMa-2): results from two double-blind,
randomised, placebo-controlled and
ustekinumab-controlled phase 3 trials. Lancet.
2018;392(10148):650-661.
9. Moschen AR, Tilg H, Raine T: IL-12, IL-23 and
IL-17 in IBD: immunobiology and therapeutic
targeting. Nat Rev Gastroenterol Hepatol.
2019;16(3):185-196.
10. Feagan BG, Panés J, Ferrante M, et al:
Risankizumab in patients with moderate to severe
Crohn's disease: an open-label extension study.
Lancet Gastroenterol Hepatol.
2018;3(10):671-680.
11. Abraham C, Dulai PS, Vermeire S, et al:
Lessons learned from trials targeting cytokine
pathways in patients with inflammatory bowel
diseases. Gastroenterology.
2017;152(2):374-388.e4.
12. Al-Salama ZT, Scott LJ: Guselkumab: a review
in moderate to severe plaque psoriasis. Am J
Clin Dermatol. 2018;19(6):907-918.
13. Johnson&Johnson: Janssen presents study
results showing clinical efficacy for TREMFYA®
(guselkumab) and long-term safety profile for
STELARA® (ustekinumab) for patients living with
inflammatory bowel disease at Digestive Disease
Week® 2022
https://www.jnj.com/janssen-presents-study-results-showing-clinical-efficacy-for-tremfya-guselkumab-and-long-term-safety-profile-for-stelara-ustekinumab-for-patients-living-with-inflammatory-bowel-disease-at-digestive-disease-week-2022
14. 陳西蕙、謝永宏 :
生物製劑用於中重度克隆氏症之療效與安全性。台灣臨床藥學雜誌2022;30:117-128
https://www.airitilibrary.com/Article/Detail/10275096-202204-202206290011-202206290011-117-128
15. Official consumer Website for TREMFYA®:
prescribing information of Tremfya
https://www.janssenlabels.com/package-insert/product-monograph/prescribing-information/TREMFYA-pi.pdf