治療新冠肺炎的抗病毒藥物的肝毒性是因果關係還是巧合?
鄭人慈、黃聖翰
高雄長庚紀念醫院藥劑部
摘要
目前台灣健保核准抗病毒藥物作為治療新冠肺炎的主要療法,使用的有Remdesivir、Paxlovid與Molnupiravir。近期部份的系統性回顧文章認為新冠肺炎病患發生的肝損傷可能跟新冠肺炎治療的抗病毒藥物有關,然而這之間的關聯仍沒有被直接證實,全世界關於這類的研究進行因果關係的評估資料也很缺乏。本篇我們進行系統性的搜尋,並摘要了前述的三種的新冠肺炎抗病毒藥物所導致肝損傷進行的研究,RUCAM評分機制是目前公認可以用來評估藥物誘發肝損傷的因果關係,經過評估我們認為Remdesivir,Paxlovid及Molnupiravir在新冠肺炎病患發生肝損傷的因果關係程度分別為「極有可能」、「可能」跟「不太可能」,另外也發現新冠肺炎本身也是影響RUCAM的因子。針對新冠肺炎發生肝功能異常的情況我們建議要密切監測肝功能,特別針對幾個共同存在導致肝損傷的因子:選用Remdesivir作為治療藥物、病人同時具有多重藥物治療或是肝臟相關的疾病史。
關鍵字:
COVID-19、DILI、RUCAM、Remdesivir、Paxlovid、Molnupiravir
壹、前言
新冠肺炎的疫情目前雖已趨緩和,但根據目前的醫療策略-針對中重症的病人給予住院及使用抗病毒藥物治療-台灣於2022年的死亡率每十萬人口仍有62.9人次,僅次於癌症跟心臟相關疾病1,追究其死亡原因可能很多元:病情的進展、病人本身的健康狀況、不預期的藥物作用與藥物間交互作用等,相關研究顯示藥物誘發肝毒性(Drug
induced liver injury, DILI)可能是其中一種主要的原因,然而就病理機轉而言,新冠肺炎病毒本身會造成肝臟的傷害2,另外中重度病患多為高齡或罹患多種慢性疾病的患者,這些患者可能在使用抗病毒藥物之前就有肝臟損傷的危險因子:脂肪肝、病毒性肝炎、膽汁鬱積等,多種慢性疾病的多重用藥所導致的交互作用也更進一步造成肝臟損傷,這些因素也增加了DILI因果關係評估的困難3。由於抗病毒藥物目前用於新冠肺炎的治療仍屬於一次性療程,嚴重的不良反應可能會中斷療程而影響治療的效果,因此謹慎評估DILI並給予適當的處置,對於使用抗病毒藥物治療新冠肺炎的病患是迫切需要的。
RUCAM量表4是目前評估DILI因果關係的標準化量表,利用7個主要的評估項目包含:一、開始用藥到發生肝損傷的時間,二、停藥之後肝指數回復的過程,三、生活習慣當中的危險因子,四、同時併用藥物/中草藥,五、排除其他非藥物原因造成的肝損傷,六、對象藥物是否有相關肝毒性資料,七、該藥物再次使用的反應。根據評分級距將藥物與肝損傷的相關性分為5級(見表1):非常極有可能、極有可能、可能、不太可能、排除。相較於常用來評估藥物不良反應的Naranjo
score,RUCAM量表是特定用於肝臟損傷,且具有高度靈敏度、準確度與預測能力3,目前已開發成電腦化的版本RECAM5可供線上即時評分(http://gihep.com/dili-recam/),本篇回顧主要是為了了解治療新冠肺炎的抗病毒藥物與肝損傷的關聯性,我們利用文獻搜尋的方式,對照目前台灣現行使用在新冠肺炎的抗病毒藥物,透過RUCAM的評估來確定到底之間的關聯性是因果關係還是巧合?
表1 RUCAM評分所對應DILI的相關性
貳、文獻探討
文獻搜尋利用PubMed與Google scholar資料庫,關鍵字是以{COVID-19
AND liver test abnormalities AND Remdesivir,
Paxlovid and Molnupiravir AND DILI OR RUCAM},這些目前健保認可用於新冠肺炎的抗病毒藥物引發肝指數異常的研究有36篇,但最後符合所有搜尋條件的文獻共有3篇6-8,可能的原因是:一、大部分報告屬於回溯性研究可能會受限於資料的不完整或是缺乏適當地篩選條件;二、相關的世代研究相對於前瞻性研究的同質性而言品質上比較複雜,甚至有些研究將住院跟門診的資料合併再一起,有些則是藥物上包含傳統中草藥卻沒有將其跟西藥個別分析;三、由於新冠肺炎病毒本身就會誘發肝臟傷害9,沒有經過RUCAM評估因果關係的研究無法判定發生肝損傷的機率單純是由藥物(特定單一藥物)引起的,這個議題往後的研究可以作進一步的探討10。綜合上述的原因本文主要整理三篇文獻對於抗病毒藥物誘發肝毒性的分析結果,來釐清新冠肺炎使用抗病毒藥物治療誘發肝毒性的因果關係及其他相關的危險因子,最後探討新冠肺炎的抗病毒藥物發生DILI後的處置。
參、結果與討論
一、Remdesivir誘發肝毒性的因果關係
在Delgado et al.6的研究結果中,雖然Remdesivir發生DILI的個案數在所有研究中DILI的比例不是最高的(14/160,
8.75%),但從換算成定義每日劑量(defined daily dose, DDD)來看,其發生DILI的機率卻是所有治療新冠肺炎藥品當中最高的(992.7/10,000
DDD),且Remdesivir的ALP (alkaline
phosphate)指數的上升又相較其他藥物更為顯著,代表其所導致的肝臟損傷比較屬於膽管方面的傷害,另外也有85.7%的比例因為高轉胺酶血症(Hypertransaminasaemia)的關係而停藥。由於這些DILI的個案是從RUCAM量表評分達3分以上者,在14個當中更有6個個案為Probable的評級,明顯排除了先前有相關肝功能異常的危險因子之後,Remdesivir仍具有一定誘發肝損傷的風險。從系統性回顧與統合分析的研究顯示11:使用Remdesivir的208個病患中發生DILI的比例為15.2%,其中高轉胺酶血症跟AST上升分別占了10%跟5%,另外也提到一個多醫學中心的研究有23%的使用Remdesivir發生DILI的病患也發生高轉胺酶血症並因此而停藥的。
二、Paxlovid、Molnupiravir誘發肝毒性的因果關係
兩篇系統性回顧的文章7,8雖然沒有明確使用RUCAM量表評估DILI,但標示了Paxlovid、Molnupiravir誘發的肝毒性類型為肝細胞型,一般認為新冠肺炎病毒造成的肝臟損傷主要為膽管型-病毒的受體ACE-2大部分存在膽管細胞;另外膽管在肝臟再生跟相關免疫反應中扮演重要的角色,直接傷害膽管細胞可能會導致血管內皮細胞誘發高凝血狀態,造成門脈循環系統的凝血異常,另外也刺激免疫系統細胞激素(cytokines)導致細胞激素風暴(Cytokine
Storm)3-這些皆屬於膽管型肝臟損傷。因此肝細胞型DILI跟這兩種新冠肺炎的抗病毒藥物是有因果關係的。另外文獻內容顯示:檢查數值都只是輕微上升;沒有明顯的臨床症狀跟更進一步的資料;就停藥之後數值恢復正常;另外參考Paxlovid有案例報導會增加急性肝衰竭的風險12,因此在因果關係的程度判定上,Paxlovid及Molnupiravir分別為「可能」跟「不太可能」。
肝臟相關疾病史會促進抗病毒藥物誘發肝毒性
相同的回顧文獻分析顯示11:先前罹患慢性肝病的比例在新冠肺炎無論哪一種程度的確診者都差不多(3.6%),但有慢性肝病史或肝指數異常的個案,死亡病患的勝算比(odd
ratio,
OR)可升高到3.46,可以判定罹患慢性肝病或是所謂代謝異常相關型的脂肪肝(metabolic
dysfunction-associated fatty liver, MAFLD),都會增加發生DILI的機會(如圖1所示)。
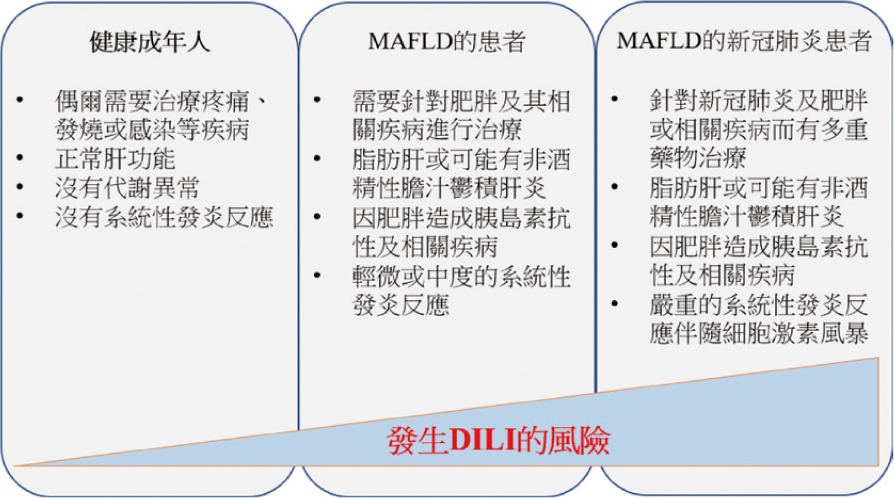
圖一 新冠肺炎伴隨代謝異常型脂肪肝可能會增加DILI的風險6
三、多重用藥會促進抗病毒藥物誘發肝毒性
分析本土新冠肺炎死亡率的危險因子:罹患慢性疾病的患者超過99%1,從慢性疾病的種類來看,心血管疾病、中風、高血壓、糖尿病、高血脂比例皆超過3成,由於這些共病治療會造成多重用藥-本身就有交互作用的風險,許多慢性疾病的用藥會影響到肝臟酵素(抑制CYP3A),導致抗病毒藥物的代謝受到影響,更容易增加DILI發生率跟嚴重度3,建議有這類風險因子的新冠肺炎患者,除了呼吸道、生命徵象等新冠肺炎例行性檢查之外,無論是否投予抗病毒藥物都要密切監控肝功能,以利於確認DILI的發生並及早做處置。
四、DILI的評估
標準評估DILI的流程與RUCAM的使用時機如圖2所示13,在評估DILI之前須記錄病患背景資料、確認是否有不同的診斷,以排除非藥物的因素。值得注意的是:雖然RUCAM是用來判斷DILI因果評估的標準量表,但所針對的類型主要是肝細胞型、膽管型或混合兩種類型的損傷(R值的運算),針對血管型(門脈血管)的肝損傷則不適用。由於新冠肺炎病毒本身就有可能造成膽管型、血管型的肝臟損傷3,未來可以考慮將新冠肺炎本身當成DILI誘發的危險因子,對RUCAM量表作進一步的調整。
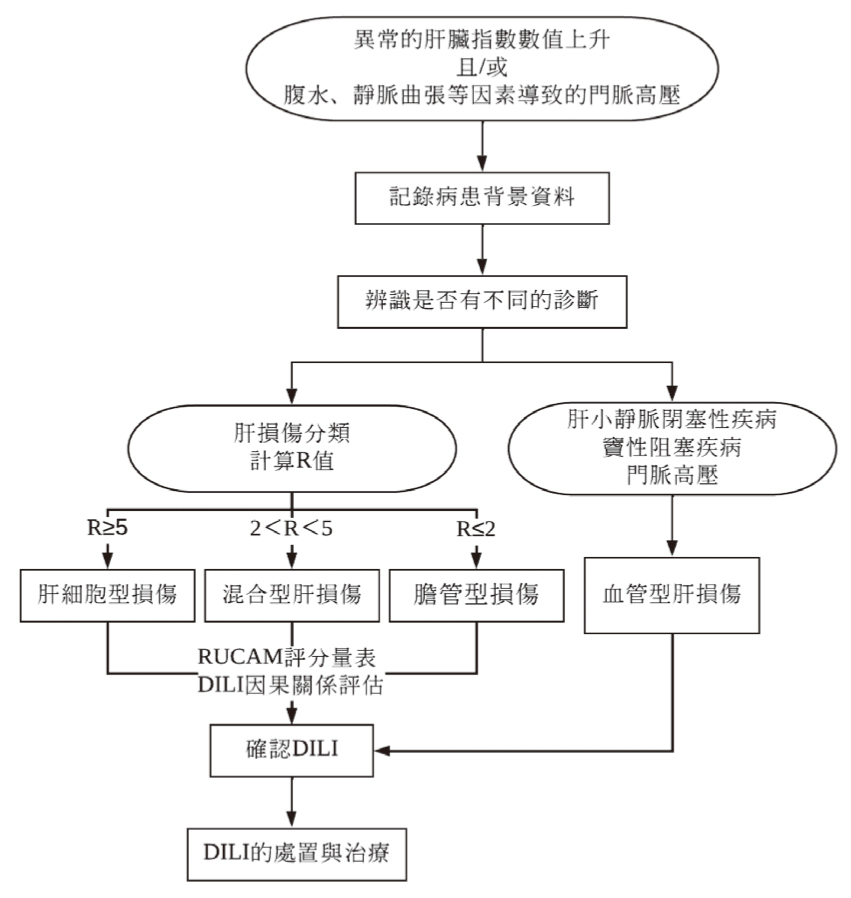
圖2 評估DILI的流程13
五、新冠肺炎抗病毒藥物發生DILI的建議處理原則14
目前沒有針對新冠肺炎病患服用抗病毒藥物發生DILI的標準處理流程15,鑑於新冠肺炎的抗病毒藥物發生DILI都是重複服用之後發生,而整個抗病毒藥物都要完整服用5天的療程,一般建議若是使用Remdesivir發生DILI的患者,可調整成Paxlovid或Molnupiravir,以確保治療的完整性;一般對亞洲人而言,因服用新冠肺炎抗病毒藥物而發生DILI的情況較為輕微,除非發生轉胺酶指數超過成正常值5倍的情況,否則不建議停止新冠肺炎重症患者停止抗病毒藥物的治療;由於抗病毒藥物導致的DILI為肝細胞型,臨床上可考慮使用N-acetylcysteine
(NAC)可作為解毒劑或肝臟保護劑,另外文獻也建議持續性靜脈輸注NAC可用於非乙醯胺酚(Acetaminophen)導致的急性肝衰竭16,可作為Paxlovid發生急性肝衰竭時使用。其他相關事宜可參考一般性DILI的處理原則17:
(一) 及早診斷DILI並暫停導致DILI的藥物以避免發生不可逆的肝損傷。
(二) DILI導致的急性肝衰竭需要緊急考量肝臟移植的轉介,另外成人治療DILI導致的急性肝衰竭建議使用靜脈注射的NAC
(三) 大劑量血漿置換術可供DILI導致的肝衰竭的一種選擇,特別針對肝臟移植無法立即提供的情況下。
肆、結論
總括而言,抗病毒藥物Remdesivir, Paxlovid及Molnupiravir在新冠肺炎病患發生肝損傷的因果關係程度依照RUCAM評估、DILI類型及發生率分別為「極有可能」、「可能」跟「不太可能」,文獻回顧及統合分析的結果也看到這些藥物會造成天門冬氨酸轉胺脢、膽紅素一定比例的上升;由於新冠肺炎病毒本身也是導致DILI的風險因子,未來RUCAM的評估可能因為新冠肺炎而有所調整;建議感染新冠肺炎的3個特定的族群:多重用藥的病患、罹患新冠肺炎前就有慢性肝病或MAFLD的患者,需在使用抗病毒藥物的時候密切監測肝功能,根據DILI的評估原則跟發生時的處置,避免該藥物發生或病情發生不可逆的肝損傷,以提升病人的用藥安全。
Liver Injury from Antiviral
Agents for COVID-19: Causality or Coincidence?
Ren-Ci Zheng, Shan-Han Huang
The Department of Pharmacy, Kaoshiung Chang Gung
Memorial Hospital
Abstract
Antiviral agents for SARS-CoV-2 are major
strategies for coronavirus disease 19 (COVID-19)
treatment in Taiwan including Remdesivir,
Paxlovid and Molnupiravir, which are approved by
Taiwan National Health Insurance. The current
systematic review searched for published
COVID-19 cases with suspected liver injury
induced by antiviral agents. However, the
pattern is still not confirmed, and data
worldwide on drug-induced liver injury (DILI)
cases assessed in COVID-19 patients whether
using these antiviral agents were sparse. In
this article, we summarized the studies
associated with liver injury from
above-mentioned three antiviral agents for
COVID-19 utilizing systematic research. RUCAM (Roussel
Uclaf Causality Assessment Method) score for
DILI causality assessment. The levels of liver
injury causality between Remdesivir, Paxlovid
and Molnupiravir for COVID-19 patients are
“probable”, “possible” and “unlikely”,
respectively. Moreover, COVID-19 may be an
important factor that influenced the RUCAM
assessment. Intensive liver function monitoring
should be considered for COVID-19 patients,
especially patients present several concomitant
factors, which individually can favor DILI:
Remdesivir treatment, polypharmacy, and
pre-existing liver disease.
參考資料:
1. 衛生福利部統計處. 民國111年國人死因統計結果-分析. 2023. Accessed
0612, 2023.
2. Kariyawasam JC, Jayarajah U, Abeysuriya V,
Riza R, Seneviratne SL. Involvement of the Liver
in COVID-19: A Systematic Review. Am J Trop Med
Hyg. 2022;106(4):1026-1041.
3. Ferron PJ, Gicquel T, Mégarbane B, Clément B,
Fromenty B. Treatments in Covid-19 patients with
pre-existing metabolic dysfunction-associated
fatty liver disease: A potential threat for
drug-induced liver injury? Biochimie.
2020;179:266-274.
4. Teschke R, Méndez-Sánchez N, Eickhoff A.
Liver Injury in COVID-19 Patients with Drugs as
Causatives: A Systematic Review of 996 DILI
Cases Published 2020/2021 Based on RUCAM as
Causality Assessment Method. International
journal of molecular sciences. 2022;23(9).
5. Hayashi PH, Lucena MI, Fontana RJ, et al. A
revised electronic version of RUCAM for the
diagnosis of DILI. Hepatology (Baltimore, Md.).
2022;76(1):18-31.
6. Delgado A, Stewart S, Urroz M, et al.
Characterisation of Drug-Induced Liver Injury in
Patients with COVID-19 Detected by a Proactive
Pharmacovigilance Program from Laboratory
Signals. Journal of clinical medicine.
2021;10(19).
7. Kariyawasam J, Jayarajah U, Abeysuriya V,
Riza FR, Seneviratne PS. Involvement of the
Liver in COVID-19: A Systematic Review. The
American Journal of Tropical Medicine and
Hygiene. 2022;106.
8. Papagiouvanni I, Kotoulas SC, Pataka A, et
al. COVID-19 and liver injury: An ongoing
challenge. World journal of gastroenterology.
2023;29(2):257-271.
9. Imam MT, Almalki ZS, Alzahrani AR, et al.
COVID-19 and severity of liver diseases:
Possible crosstalk and clinical implications.
International immunopharmacology.
2023;121:110439.
10. Villanueva-Paz M, Niu H, Segovia-Zafra A, et
al. Critical Review of Gaps in the Diagnosis and
Management of Drug-Induced Liver Injury
Associated with Severe Cutaneous Adverse
Reactions. Journal of clinical medicine.
2021;10(22).
11. Kulkarni AV, Kumar P, Tevethia HV, et al.
Systematic review with meta-analysis: liver
manifestations and outcomes in COVID-19.
Alimentary pharmacology & therapeutics.
2020;52(4):584-599.
12. Wong CKH, Mak LY, Au ICH, et al. Risk of
acute liver injury following the nirmatrelvir/ritonavir
use. Liver international : official journal of
the International Association for the Study of
the Liver. 2023;43(12):2657-2667.
13. Yu YC, Mao YM, Chen CW, et al. CSH
guidelines for the diagnosis and treatment of
drug-induced liver injury. Hepatology
international. 2017;11(3):221-241.
14. Allison R, Guraka A, Shawa IT, Tripathi G,
Moritz W, Kermanizadeh A. Drug induced liver
injury - a 2023 update. Journal of toxicology
and environmental health. Part B, Critical
reviews. 2023;26(8):442-467.
15. Karlafti E, Paramythiotis D, Pantazi K, et
al. Drug-Induced Liver Injury in Hospitalized
Patients during SARS-CoV-2 Infection. Medicina (Kaunas,
Lithuania). 2022;58(12).
16. Walayat S, Shoaib H, Asghar M, Kim M,
Dhillon S. Role of N-acetylcysteine in
non-acetaminophen-related acute liver failure:
an updated meta-analysis and systematic review.
Annals of gastroenterology. 2021;34(2):235-240.
17. Wu H, Liu S, Luo H, Chen M. Progress in the
Clinical Features and Pathogenesis of Abnormal
Liver Enzymes in Coronavirus Disease 2019.
Journal of clinical and translational hepatology.
2021;9(2):239-246.

