簡述帶狀疱疹疫苗的成本效益
陳柳蒼
新竹國泰綜合醫院藥劑科
摘要
帶狀疱疹(Herpes zoster;
HZ)的發生率在50歲以上會急劇上升,隨著HZ病例數增多,所併發的HZ後遺症,如疱疹後神經痛(Postherpetic
neuralgia; PHN)、視力喪失等也將同時增加。首先,臨床研究已經證實帶狀疱疹疫苗在預防HZ方面具有顯著效果。它可以降低HZ發生率,減輕症狀和疾病持續時間,並減少疱疹後神經痛的風險。另一方面,透過藥物經濟學的大數據成本效益統計分析,可以對不同品牌帶狀疱疹疫苗的成本效益進行比較。總體而言,接種帶狀疱疹疫苗不僅可以減少個人癒後醫療支出,還可以降低整個社會總醫療成本。對於面臨人口老化和疾病負擔的社會來說,這極其關鍵,不可忽視。
關鍵字: 帶狀疱疹疫苗、藥物經濟學、成本效益、Shingrix
壹、前言
帶狀疱疹是一種由水痘-帶狀疱疹病毒(Varicella zoster virus; VZV)在帶原者身上重新激活的病毒感染症。HZ病毒會再透過病患飛沫、體液等途徑傳染給非帶原者得到水痘,並藏匿在背根神經節或腦感覺神經節中。HZ初期階段會表現出皮膚瘙癢或麻木、神經抽痛、單側皮瘤狀疼痛等,最後演變成間歇疼痛性水皰皮疹。雖然HZ相關死亡率低,但HZ嚴重後遺症將耗費龐大社會醫療成本。50歲以上成人HZ的發生率和嚴重度上升原因,歸因於VZV特異性T細胞免疫低下所導致。HZ癒後常見後遺症為PHN、面癱、中風和視力喪失等不良事件,尤其是PHN會嚴重影響患者HZ癒後的生活品質。全球超過95%的50歲以上成人都曾接觸過VZV,導致大多數人都有罹患HZ的風險,因此選擇疫苗接種來預防HZ是一項重要的公共健康事項1。
貳、帶狀疱疹疫苗簡介
目前有兩種帶狀疱疹疫苗可供預防使用:減毒活性疫苗和基因重組疫苗。
一、減毒活性疫苗(Zoster vaccine LIVE; ZVL; Zostavax®)
ZVL早在2006年從U.S.FDA獲得使用許可,用於預防50歲以上免疫功能正常個體,該疫苗的最低效價為19400
PFU,屬於冷凍乾燥製成之Oka株減毒疫苗。自2020年7月起,ZVL便不在美國銷售利用,原因為其平均成功率只有50%左右1,3,然而它在許多其他國家或地區仍繼續使用當中。給藥方式為一次性0.65mL皮下注射給藥,保護力維持5年後便急速下降至40%。
二、 基因重組疫苗(Recombinant zoster vaccine; RZV;
Shingrix®)
RZV是重組DNA技術生產的疫苗,稱為基因重組疫苗,是將培養及純化後的病毒表面醣蛋白抗原(Glycoprotein
E; gE)打入人體,經細胞胞飲作用以模擬宿主病毒感染,並引發專一性免疫反應。RZV於2017年10月在美國首度上市,只用於50歲以上正常免疫個體預防注射;而令人慶幸的是U.S.FDA在2021年擴大適應症範圍,增加18歲以上免疫功能低下危險群可以使用。RZV含有抗原g
E和佐劑AS01B (QS-21、MPL、微脂體之複方佐劑),在體內可同時增強抗體反應和CD4+
T細胞免疫反應,此種雙高免疫現象可持續10年。RZV必須肌肉注射兩劑,每次0.5mL劑量才能完整提供保護,兩劑給藥須間隔2〜6個月,保護力持續7年後仍有84%效力。

圖一 RZV疫苗細胞免疫運作方式1
參、藥物經濟學的成本效益方法
一、 成本效益分析(Cost-effectiveness analysis; CEA)
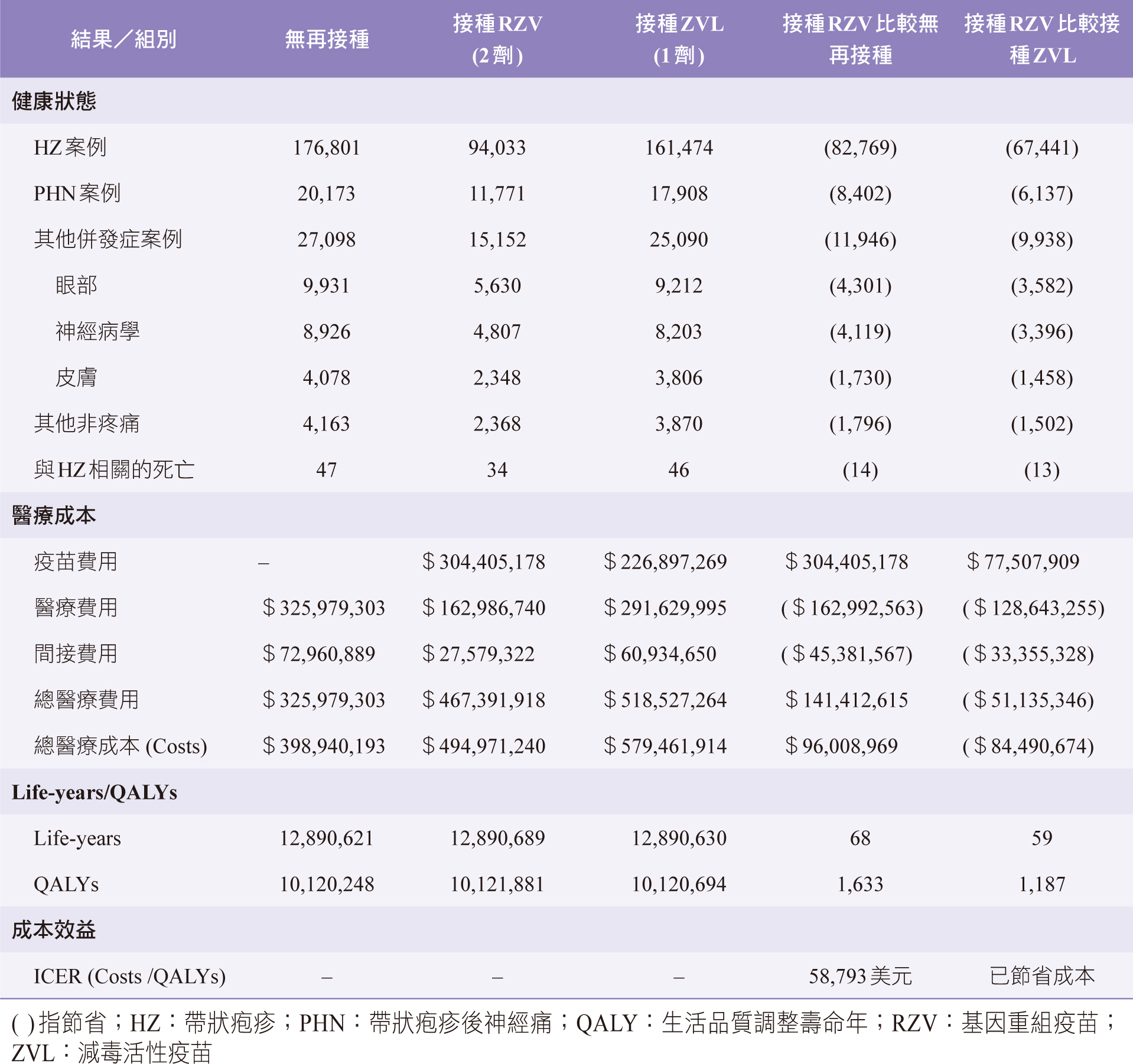
CEA是一種經濟分析形式,可用於分析帶狀疱疹疫苗成本效益。這種分析形式有助於比較不同品牌的疫苗,找出具有效果好且成本佳的產品4,5。如表一、舉例美國聯邦政府醫療保險疫苗試驗計劃,採樣統計100萬人分無再接種、接種RZV及接種ZVL的三組統計結果,然後再將所得結果進行碰頭比較差異。統計對象選擇曾有ZVL接種史至少5年的60歲以上美國成年人,以確保案例的基礎免疫功能一致。年齡次分層是採用馬爾可夫模型的年齡隊列方式,分成60-64歲、65-69歲、70-79歲、80+歲四組,讓採樣對象更廣泛收集。該模型採樣的壽命年(Life-years)為隊列中受試者當年接種帶狀疱疹疫苗起,直至生命終結為止2。
(一)健康狀態(Health Outcomes)
如表一、得知組別統計結果:接種RZV比較無再接種,差異值為減少HZ病例82,769件,減少8,402件PHN案例;接種RZV比較接種ZVL,差異值為減少67,441件HZ病例,減少6,137件PHN案例。由大數據統計顯示:接種RZV可大幅減少HZ案例,而與HZ相關的死亡率為0.0034%以下。
(二)總醫療成本(Costs)
接種RZV與接種ZVL在無考量疫苗費用下,都能降低直接費用(Direct
costs)支出,包括疾病治療費、不良反應治療費,以及未來因應預防疾病或降低發病率的費用;同時也降低間接費用(Indirect
costs)支出,包括食物、交通、住宿、衣物、照顧者或因生病而由家庭成員提供的援助。所謂Costs是計算疫苗費用、直接費用和間接費用的綜合2,4,雖然接種疫苗組比無再接種組加增疫苗費用,但考量到接種疫苗對HZ預防成效顯著時,這些加增的費用是必須投注的。進一步比較分析,如表一、組別:接種RZV比較接種ZVL,接種RZV可節省Costs約8,449萬美元。
二、遞增成本效益比(Incremental Cost-Effectiveness Ratio;
ICER)之計算
(一) 了解生活品質調整壽命年(Quality-adjusted life years;
QALYs)
QALYs是一種用於量化健康狀態的指標,其計算方式為Life-years乘以Utility而得出。Utility值介於0至1之間
(1表示完全健康,0表示死亡);而Utility可用問卷方式(EQ-5D、SF-36等)來定值6,7。按照時間折算法的推算,假設某個患者在現有疾病症狀下生存10年,若完全轉換成完美健康且無須治療狀態下,可累積存活8年,則該患者未來10年將被視為擁有8個QALYs,這表示其Utility值為0.8。如表一、組別:統計接種RZV的Life-years為12,890,689年,經Utility校正後,得到接種RZV的QALYs為10,121,881年。
(二)遞增成本效益比(ICER)8
ICER是用於評估醫療技術成本效益的重要指標,可瞭解每個QALY所需付出的成本。計算ICER可將Costs差值除以Effectiveness差值。如表一、組別:接種RZV比較無再接種之疫苗費用加增304,405,178美元,醫療費用節省162,992,563美元,間接費用節省45,381,567美元,結算Costs差值等於96,008,969美元。而接種RZV比較無再接種的QALYs差值為1,633年,所以ICER計算值為96,008,969除以1,633等於58,793美元。
(三) ICER與成本效益閾值(Cost-Effectiveness Threshold;
CET)的關係9
CET用於界定醫療干預措施是否物當所值,值得被醫療保健系統採用。根據WHO組織建議,CET值設定在低於3倍人均GDP,可被視為具成本效益。但這種方法有侷限性,CET值設定過低,病患得不到適當有效醫療;若設定值過高,將誘使藥品定價居高不下,侵蝕健保資源。本例接種RZV得到ICER為58,793美元,低於美國醫療CET值100,000美元,代表其符合成本效益。
三、平均成本效益比(Average Cost-Effectiveness Ratio;
ACER)之計算10
ACER是計算成本效益的另一種方式,只要考量單項疫苗費用而排除其它費用。優點在於它可快速且直觀地解釋疫苗成本效益,常作為初步性判定。計算ACER可將疫苗費用除以Effectiveness值,商越低,代表其成本效益越好。但缺點是它具有誤導性,易忽略其他健康問題、併發症及長期醫療成本,也無法校正個體間的健康差異。
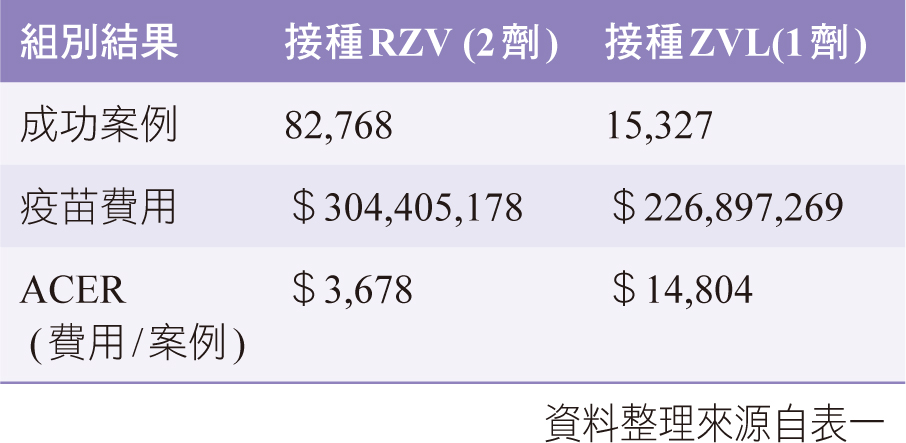
表二 帶狀疱疹疫苗平均成本效益比ACER
如表二、ACER計算:美國醫療保險計畫從受試100萬人中統計得出82768名60歲以上的成年人因接種RZV而成功避免HZ危害,就需要投入3.04億美元RZV疫苗費用,也就是說接種RZV的ACER為3,678美元;由表二得知,接種RZV的ACER最低,具成本效益。
四、敏感度分析(Sensitivity Analysis)2,4
(一) 確定性敏感度分析(Deterministic Sensitivity Analysis;
DSA)
DSA是一種項目敏感度的評估分析。操作DSA時,在確定項目下收集整組有關ICER的異動情形,進而判斷確定項目的敏感度。這整組變量(Variables)會依序連結成長帶狀,帶狀長度越長表示敏感度越高;同時也界定出ICER上限值與下限值,其目的是為了分析出可靠的變因。
見圖二、龍捲風圖(Tornado
Diagram)是讓DSA呈現視覺化效果的圖表,幫助研究人員識別重要項目,並針對確定項目的變因進作一步分析。確定項目中可看出ICER敏感強度的前五名,順序分別為RZV疫苗效果年度衰減、群體年齡、追加疫苗接種時間、貼現率和HZ發生率等。從最敏感的RZV疫苗效果年度衰減幅度項目中分析觀察發現:若打一劑RZV,因為免疫力逐年削減過大而保護力缺失時,造成ICER最大上限為179,567美元,約為基準值58,793美元的
三倍;倘若完整施打兩劑RZV延緩疫苗效果年度衰減,其ICER得到最低下限3,453美元。
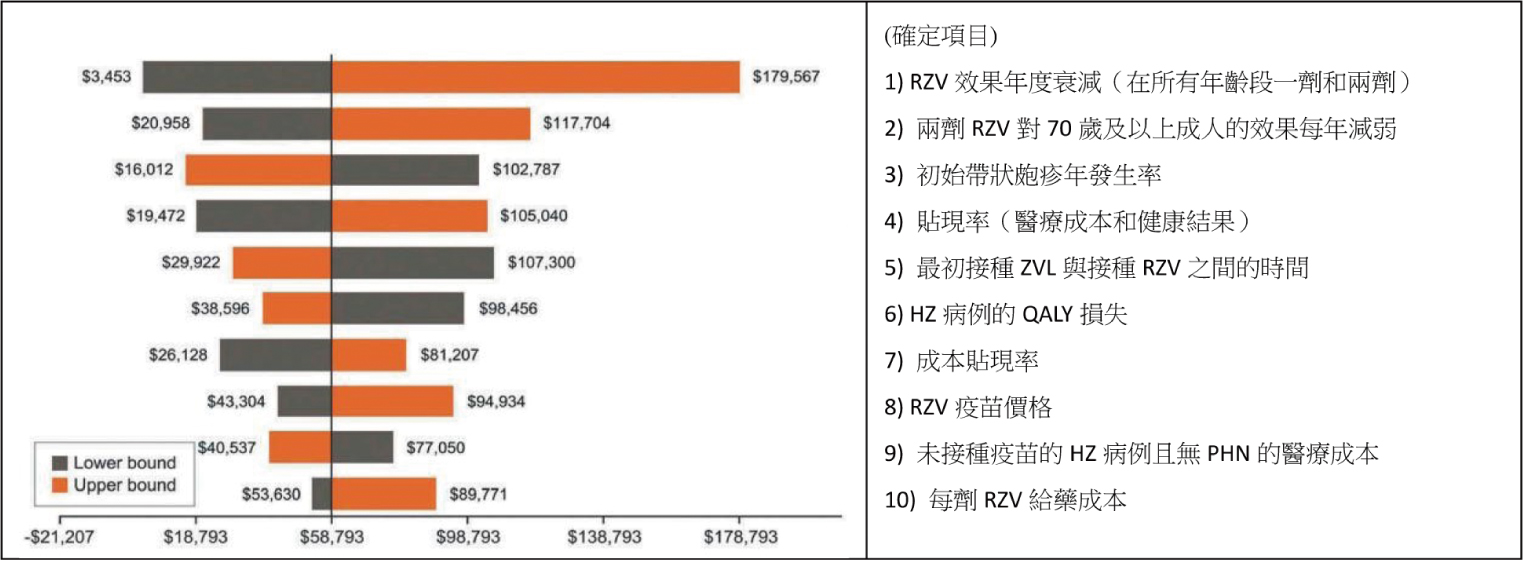
圖二 確定性敏感度分析DSA的龍捲風圖2
(二) 概率性敏感度分析(Probabilistic Sensitivity Analysis;
PSA)
PSA是使用概率分佈來描述成本效益,與傳統的確定性敏感度分析不同。確定性敏感度分析只考慮確定項目的變數變化對成本效益的影響,而PSA通過模擬多項目多變數組合來評估不確定性對成本效益的影響。模擬多項目多變數組合是一種蒙特卡羅模擬法(Monte
Carlo
Simulation),它同時模擬多個影響成本效益的不確定因素,包括治療費用、疾病發生率、治療效果等。使用隨機抽樣和模擬,可以取得ICER數據點,獲得不同策略概率分佈,幫助研究人員做出判定。
見圖三、遞增成本效益比平面圖(ICER
Plane)是呈現成本效益分佈的工具。它是二維平面圖,其中橫軸表示QALY差值,縱軸表示Costs差值。對於每個蒙特卡羅模擬法模擬結果,將得到ICER數據點,並點在圖上進行標記。ICER
Plane上顯示多達5,000個分佈點,可估大約75%受試者在接種RZV後的模擬數據點(灰點)落在CET黑色閥值線100,000美元下方,顯示接種RZV成本效益佳。另外大約96%接種RZV比較接種ZVL之模擬數據點(橘點)落在黑色線下方,顯示接種RZV替代接種ZVL是符合成本效益的。
目前帶狀疱疹疫苗首推基因重組疫苗(RZV),它對於50歲以上成人防護成功率達到90%,且疫苗有效性持續7年以上,也可以降低疱疹後神經痛和視力喪失等後遺症的嚴重度。從藥物經濟學的角度來看,數據統計顯示接種RZV的平均成本效益比和遞增成本效益比都是非常合算且物當所值,可以節省大量的總醫療成本11。若從確定性和概率性的敏感度分析可證實,給藥間隔2〜6個月,完整接種兩劑RZV是最佳的預防保健策略。對於HZ高風險人群來說,不論是由醫療保健系統給付RZV費用或由個人自費接種,都有助於節省帶狀疱疹相關的總醫療成本,同時還可增進個人生活品質調整壽命年的潛在效益。
A Brief Overview
of the Cost-Effectiveness on The Herpes Zoster
Vaccine
Liu-Tsang Chen
Department of Pharmacy, Hsinchu Cathay General
Hospital
Abstract
The incidence of herpes zoster rises sharply
after the age of 50, and HZ complications such
as post-herpetic neuralgia and vision loss are
expected to increase with the number of HZ
cases. Firstly, clinical studies have confirmed
the significant effectiveness of the herpes
zoster vaccine in preventing HZ. It can reduce
the incidence of shingles, alleviate symptoms,
shorten the duration of the disease, and lower
the risk of PHN. On the other hand, through the
utilization of big data statistics in
pharmacoeconomics, a comparison among the
different brands of HZ vaccines in
cost-effectiveness is conducted. Vaccination
against HZ can not only save individuals from
post-recovery medical expenses but also lower
the overall societal healthcare costs. This is
particularly crucial for societies dealing with
aging populations and disease burdens.
參考資料:
1. Catherina X. Pan, Michelle S. Lee, Vinod E.
Nambudiri: Therapeutic Advances in Vaccines and
Immunotherapy 2022;10:1-19
2. Desmond Curran a, Brandon J. Pattersonb,
Desiree Van Oorschota, et al: Human vaccines &
immunotherapeutics 2019;15(4):765-771
3. WHO:Position paper on varicella and herpes
zoster vaccines 2014;89:265-288
4. Bruce Y.Lee,Michael M.Wagner,Agnieszka Onisko,
et al: Economic Studies in
Biosurveillance:Handbook of Biosurveillance
2006;p423-435
5. 梁賡義, 吳成文, 陳杰峰, et al: 醫療資源使用之效益評估-低效醫療之探討:
國家衛生研究院委員會作 2018-08;3;47-57
6. Makoto Shiragami, Akiko Mizukami, Toshihiko
Kaise, et al: Dermatol Ther(Heidelb)
2019;9:281-297
7. Ashleigh McGirr1,Desiree Van Oorschot2,Robyn
Widenmaier, et al: Applied Health Economics and
Health Policy 2019;17:723-732
8. 蒲若芳:揭開ICER神秘的面紗:臺灣藥物經濟暨效果研究學會會訊2020-02
9. André Soares Santos, Augusto Afonso
Guerra-Junior, Brian Godman, et al:
Cost-effectiveness thresholds: methods for
setting and examples from around the world:
Expert Review of Pharmacoeconomics and Outcomes
Research;18(3);277-288
10. Bang, Heejung and Hongwei Zhao: Average
cost-effectiveness ratio with censored data:
Journal of biopharmaceutical statistics
2012;22(2);401-15
11. 譚延輝:藥事經濟學入門:九州圖書:https://www.jcbooks.com.tw/products/page/?id=183.
通訊作者:陳柳蒼/電子信箱:570217@yahoo.com.tw