治療阿茲海默症新藥-Lecanemab
李建宏、張綜瑋、彭銘麒、童玟津
員林基督教醫院藥劑課
摘要
阿茲海默症是一個使認知和記憶逐漸退化的疾病,通常在65歲以上長者中發生,症狀包括焦慮、憂鬱、冷漠、退縮、睡眠變化和判斷力受損等。可透過評估疾病嚴重程度協助選擇適合之治療方式,而目前的治療方式主要是透過改善相關症狀,並無治癒疾病之治療選項。在藥物發展上,重要假說有類澱粉假說、Tau蛋白假說和膽鹼性假說,而目前臨床上常用藥物主要是基於膽鹼性假說,例如:donepezil、rivastigmine和galantamine。Lecanemab是一種抗阿茲海默症藥物,透過抗β類澱粉蛋白生成,來減少阿茲海默症病人β類澱粉蛋白斑塊在大腦堆積所導致的神經細胞功能受損。Lecanemab已獲得美國食品藥物管理局加速核准,但仍需要適當的監測機制,以避免不良反應發生。
關鍵字: 阿茲海默症、Alzheimer's
disease、Lecanemab、Aducanumab、類澱粉假說、Amyloid
hypothesis
壹、阿茲海默症藥物簡介
阿茲海默症是一個在認知與記憶逐漸退化的疾病,通常影響65歲以上長者,干擾病人的功能及日常活動,症狀包含焦慮和憂鬱症狀,冷漠和退縮、睡眠變化、判斷受損等,其中最具臨床特色的是選擇性記憶障礙。評估疾病嚴重程度可以幫助選擇治療方式,而目前的治療方式主要是改善相關症狀,並無治癒疾病之治療選項1,2。
在藥物發展上,相關假說主要有類澱粉假說(Amyloid hypothesis)、Tau蛋白假說(Tau
hypothesis)、膽鹼性假說(Cholinergic
hypothesis);目前臨床上常使用的donepezil、rivastigmine、galantamine就是基於膽鹼性假說,藉由透過抑制膽鹼酯酶可以減緩乙醯膽鹼的分解速率,進而改善症狀1,2。膽鹼酯酶抑制劑主要用於治療輕度至中度阿茲海默症,即以簡易心智量表(Mini-Mental
State Examination, MMSE)計分分數介於10至26分之患者,因為膽鹼酯酶抑制劑之臨床藥效相似,藥物選擇通常考量耐受性、價格、病人偏好、藥物劑型等因素3。
中度至重度(MMSE≤18)之阿茲海默症病患,藥物的選擇可能會單獨選用memantine或合併膽鹼酯酶抑制劑3。Memantine之作用機轉與膽鹼酯酶抑制劑不同,作用是拮抗N-methyl-D-aspartate(NMDA)接受器,NMDA受體在學習與記憶上扮演重要角色,過度的NMDA刺激可能造成神經元及大腦受到傷害,因此memantine在阿茲海默症治療中扮演神經保護的角色4。
以類澱粉假說為基礎發展出的藥物有aducanumab和lecanemab,Aducanumab在2021年6月獲得美國食品藥物管理局加速核准,用於治療輕度認知障礙或輕度失智之阿茲海默症患者5。而本篇要介紹的lecanemab則是在2023年1月6日獲得美國食品藥物管理局加速核准之藥物6,以下針對lecanemab之藥理、療效、安全性、注意事項與交互作用進行介紹。
貳、新藥介紹
一、藥理作用
有別於膽鹼酯酶抑制劑及NDMA受體拮抗劑,Lecanemab是一種人源化IgG1單株抗體,它可以抵抗聚合型可溶性及不可溶性β類澱粉蛋白生成,進而減少阿茲海默症病人β類澱粉蛋白斑塊在大腦堆積,減少神經細胞功能受損7。
二、 給藥方式、療效與安全性
美國食品藥物管理局核准之lecanemab適應症為治療阿茲海默症,用以治療輕微認知障礙或失智患者。在美國,lecanemab目前有兩種規格,藥液濃度均為每毫升100毫克。給藥前須先稀釋,稀釋方式為:先從lecanemab藥瓶中抽出患者需要之藥量後,將lecanemab溶液注入一袋250毫升0.9%之氯化鈉注射液中,即完成稀釋步驟。稀釋完成後應立即給藥,若無法立即給藥,不論存放於冷藏(2℃至8℃)或是30℃以下之常溫環境,均不得超過4小時。Lecanemab之建議劑量為每公斤10毫克,經由靜脈輸注給藥,輸注時間應約略超過一小時。每兩週給藥一次8。
Lecanemab透過美國食品藥物管理局加速核准計畫核可,透過短時間內替代指標(surrogate
endpoint)上之資料收集,預測藥物對患者的實際臨床效果,且藥廠須進行後續確認性試驗(confirmatory
trials)9。Lecanemab的加速核准是基於一篇phase
2概念驗證臨床試驗,在這個雙盲、安慰劑對照、平行組、劑量尋找的研究中,收納共856位β類澱粉蛋白沉澱之輕度阿茲海默症病患,接受每兩週靜脈注射Lecanemab
10
mg/kg,研究發現至第79週時,大腦β類澱粉蛋白斑塊數量較安慰劑組為低,且具有統計學上的差異6,10。
另一篇多中心之第三期隨機分派臨床試驗共收納1795位受試者,以1:1的方式分組,一組(共898人)給予lecanemab以每兩週10
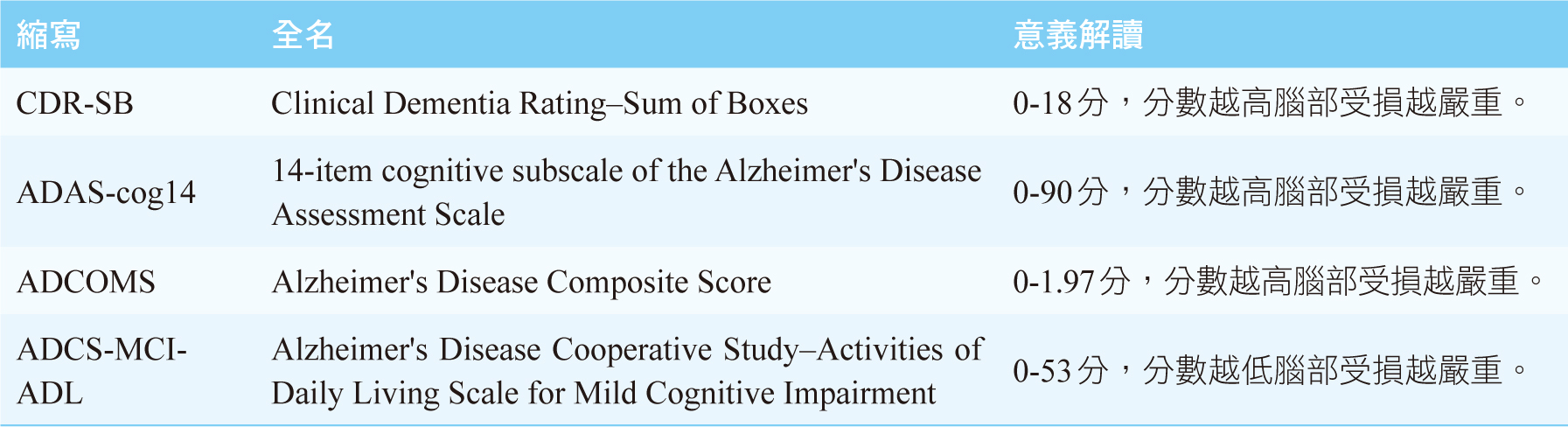
mg/kg靜脈注射;另一組(共897人)則給予安慰劑,共追蹤18個月。主要療效評量工具為CDR-SB(Clinical
Dementia Rating–Sum of Boxes)、ADAS-cog14(14-item
cognitive subscale of the Alzheimer's Disease
Assessment Scale)、ADCOMS(Alzheimer's Disease
Composite Score)和ADCS-MCI-ADL(Alzheimer's
Disease Cooperative Study–Activities of Daily
Living Scale for Mild Cognitive
Impairment),說明及檢查評定詳表一。兩組CDR-SB基準分數均為3.2分,隨著時間過去,兩組受試者的分數均下降。至第18個月時校正後之最小平方均值變化(least-squares
mean change):Lecanemab組為1.21,安慰劑組為1.66(CI: -0.67
to -0.23;P< 0.001)7。
而在一項包含698位病患的類澱粉蛋白負擔(amyloid
burden)次族群分析中,Lecanemab組原先之平均類澱粉蛋白量為77.92
centiloids,而安慰劑組為75.03
centiloids。在18個月後,自基線校正後的平均變化量(The adjusted mean
change from baseline)在lecanemab組為-55.48
centiloids,而在安慰劑組為3.64 centiloids(差異為-59.12
centiloids;95%
信賴區間為-62.64至-55.60;P<0.001)。結果顯示lecanemab相較於安慰劑組能顯著降低腦中類澱粉蛋白。在ADAS-cog14、ADCOMS、ADCS-MCI-ADL等量表的表現評估上,Lecanemab組之結果優於安慰劑組。Lecanemab組在ADAS-cog14、ADCOMS量表分數之上升較安慰劑組低,且具顯著意義;而在ADCS-MCI-ADL量表的評估中,Lecanemab組之分數降低較安慰劑組小,並具顯著意義。這些結果暗示lecanemab組患者腦部功能的退化可能較為緩慢7。
就安全性而言,使用lecanemab之受試者中有0.7%死亡,安慰組則為0.8%;發生嚴重不良反應的比例分別為14%及11.3%。在此臨床試驗中,常見副作用有輸注反應、類澱粉蛋白相關之影像學異常(Amyloid-related
imaging abnormalities,
ARIA)、頭痛及跌倒7。ARIA又分為水腫(Amyloid-related imaging
abnormalities-edema,
ARIA-E)與血鐵質沉積症(Amyloid-related imaging
abnormalities-hemosiderin,
ARIA-H)。根據此第三期隨機分派臨床試驗,78%之ARIA-E為無症狀,通常發生在治療的前三個月,並在四個月內緩解。在接受lecanemab治療的受試者中,有2.8%出現有症狀之ARIA-E,其症狀通常是頭痛、視覺障礙與意識混亂。而有症狀之ARIA-H發生率為0.7%,其症狀表現通常是暈眩,並且於整段治療期間都有可能發生。另外,腦大出血(cerebral
macrohemorrhages)在治療組與對照組的發生率分別是0.6%與0.1%7。
三、 使用與注意事項
Lecanemab之使用可能伴隨一些嚴重程度不一的腦相關副作用,仿單建議在治療開始前先做腦部磁振造影(magnetic
resonance imaging,
MRI),並在第5、7、14次輸注藥品前再做腦部MRI追蹤8。並建議於治療中病人出現疑似ARIA症狀時,進行臨床評估,若有需要,亦可追蹤腦部MRI。若出現ARIA,仿單建議依據臨床症狀之有無與症狀嚴重程度,加上腦部MRI在影像學上嚴重程度的評估,再決定繼續治療或暫時停藥。而影像學上之嚴重程度依病灶的大小與數量分為輕微、中度與重度8。綜整ARIA、直徑大於一公分的腦部出血與輸注反應發生時之處置說明詳表二。
四、 藥物交互作用
在lecanemab的phase
2概念驗證臨床試驗中發現,併用抗栓塞藥品(如:Aspirin等抗血小板藥品、抗凝血藥品)的患者,發生ARIA-H的風險並不會增加。但由於使用lecanemab有腦出血的風險,仿單建議使用lecanemab之患者若要考慮使用抗栓塞藥品或血栓溶解劑(tissue
plasminogen activator,
t-PA)時,需要特別小心8。因此,當lecanemab與抗血小板作用之藥物(像是P2Y12
inhibitors、NSAIDs、SSRIs等)、抗凝血藥物,或血栓溶解藥物合併使用時,除了依仿單建議之ARIA-H與腦出血的監測外,亦應注意患者是否有其他出血發生。另外,Lecanemab若合併使用治療肌無力症之藥物-Efgartigimod
Alfa可能削弱Fc受體結合劑之藥效,進而影響其治療效果11。
參、結語
對抗類澱粉蛋白並減少斑塊堆積是阿茲海默症治療中最新的藥物機轉,除了本文介紹的lecanemab之外,Aducanumab是另一個被美國食品藥物管理局加速核准用在阿茲海默症之治療藥物7。除了概念驗證的臨床試驗、第三期隨機分派試驗所提供臨床數據之外,也期待是否能透過蒐集真實世界與上市後藥品品質監控的資料來證實藥物之療效與風險。隨著這類全新機轉治療藥品療效與安全性證據不斷增加,期許能為受阿茲海默症所苦的病人帶來一線曙光。
Lecanemab: Newly Approved Drug for Alzheimer’s
Disease
Chien-Hung Li, Tsung-Wei Chang, Ming-Chi Peng,
Wen-Jin Tung
Department of Pharmacy, Yuanlin Christian
Hospital
Abstract
Alzheimer's disease is a progressive cognitive
and memory disorder that typically occurs in
individuals aged 65 and over, with symptoms
including anxiety, depression, apathy,
withdrawal, sleep disturbances, and impaired
judgment. Assessing the severity of the patient
can help in the choice of treatment, although
current treatments mainly focus on improving
related symptoms rather than a cure. The leading
hypotheses in drug development are the amyloid
hypothesis, the tau protein hypothesis, and the
cholinergic hypothesis. Currently, commonly used
drugs are based on the cholinergic hypothesis,
such as donepezil, rivastigmine, and
galantamine. Lecanemab is an anti-Alzheimer's
drug that reduces the accumulation of β-amyloid
plaques in the brain of Alzheimer's patients by
blocking the generation of β-amyloid protein.
Lecanemab has received accelerated approval from
the U.S. Food and Drug Administration, but
appropriate precautions and monitoring
mechanisms are required to avoid adverse
reactions.
參考資料:
1. Dos Santos Picanco LC, Ozela PF, de Fatima de
Brito Brito M, et al: Alzheimer's Disease: A
Review from the Pathophysiology to Diagnosis,
New Perspectives for Pharmacological Treatment.
Curr Med Chem. 2018;25(26):3141-3159.
doi:10.2174/0929867323666161213101126
2. Morley JE, Farr SA, Nguyen AD. Alzheimer
Disease. Clinics in Geriatric Medicine.
2018;34(4):591-601.
doi:10.1016/j.cger.2018.06.006
3. Daniel Press, Stephanie S Buss. Treatment of
Alzheimer disease. Post TW, ed. UpToDate.
Waltham, MA: UpToDate Inc.
http://www.uptodate.com. (Accessed on March 31,
2023.)
4. Weller J, Budson A. Current understanding of
Alzheimer?s disease diagnosis and treatment
[version 1; peer review: 2 approved].
F1000Research.
2018;7(1161)doi:10.12688/f1000research.14506.1
5. Cummings J, Lee G, Nahed P, et al:
Alzheimer's disease drug development pipeline:
2022. Alzheimer's & Dementia: Translational
Research & Clinical Interventions.
2022;8(1):e12295.
doi:https://doi.org/10.1002/trc2.12295
6. FDA Grants Accelerated Approval for
Alzheimer’s Disease Treatment. Press
Announcements. US Food and Drug Administration.
Updated Jan 06, 2023.
https://www.fda.gov/news-events/press-announcements/fda-grants-accelerated-approval-alzheimers-disease-treatment
7. van Dyck CH, Swanson CJ, Aisen P, et al:
Lecanemab in Early Alzheimer's Disease. N Engl J
Med. Jan 5 2023;388(1):9-21.
doi:10.1056/NEJMoa2212948
8. Leqembi (lecanemab) [prescribing
information]. Nutley, NJ: Eisai Inc; July 2023.
9. Accelerated Approval. US Food and Drug
Administration. Updated Feb 24, 2023.
https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/accelerated-approval
10. Swanson CJ, Zhang Y, Dhadda S, et al: A
randomized, double-blind, phase 2b
proof-of-concept clinical trial in early
Alzheimer's disease with lecanemab, an anti-Aβ
protofibril antibody. Alzheimers Res Ther. Apr
17 2021;13(1):80. doi:10.1186/s13195-021-00813-8
11. Emily E. Acheson, Jane Acton, Titilola
Afolabi, et al: Lecanemab: Drug information.
Post TW, ed. UpToDate. Waltham, MA: UpToDate
Inc. http://www.uptodate.com. (Accessed on March
31, 2023.)
通訊作者:李建宏/電子信箱:a114501@gmail.com