使用Darolutamide適當性評估與用藥問題
黎佳琳、陳惠玉、蔡慈貞、江俐慧
林口長庚紀念醫院藥劑部
摘要
Darolutamide是最新的第二代抗雄性素受體阻斷劑。因為結構的特異性,相較其他第二代抗雄性素受體阻斷劑藥物,有較高的親和力與較少的副作用。研究期間,衛生福利部有核准的適應症為非轉移性去勢抗性前列腺癌。本研究旨在探討Darolutamide於北部某醫院多院區的藥物臨床使用,確保用藥之合理性及安全性。本研究在六個月期間(2022年8月16日至2023年2月15日)蒐集北部某醫學中心的藥物臨床使用,針對期間就診且初次使用Darolutamide的病人為研究樣本。用於治療非轉移性去勢抗性前列腺癌的病人有14位(66.7%);仿單核准適應症外使用(off-label
use)的有7位(33.3%):轉移性荷爾蒙敏感性前列腺癌(n=1)、轉移性去勢抗性前列腺癌(n=4)與兩位病歷未載明類型之轉移性前列腺癌。其中轉移性荷爾蒙敏感性前列腺癌在研究期間之後,有獲得衛福部核准適應症,而轉移性去勢抗性前列腺癌有醫學文獻佐證有功效。安全性部分,以治療相關的不良事件來呈現。有兩位病人出現治療相關的不良事件,包括血尿、呼吸道感染及腹瀉。評估結果使用Darolutamide於前列腺癌的控制,病人耐受性良好,且未發生嚴重藥物不良反應。
關鍵字: Darolutamide、藥物使用評估、非轉移性去勢抗性前列腺癌
壹、前言
Darolutamide 是一種口服、非類固醇抗雄性素受體阻斷劑(androgen
receptor inhibitor, ARi)。具有吡唑(pyrazole)結構,因此對雄性激素受體(androgen
receptor, AR)有高度的親和力,藉此與雄性素競爭達到減緩攝護腺細胞增生的效果1。美國食品藥物管理局
(Food and Drug Administration, FDA)於2019年7月通過Darolutamide用於非轉移性去勢抗性前列腺癌(non-metastatic
castration-resistant prostate cancer, nmCRPC),而2022年8月通過與紫杉醇(docetaxel)併用治療轉移性去勢敏感性前列腺癌(metastatic
hormone-sensitive prostate cancer, mHSPC)。截至目前衛生福利部核准的適應症有nmCRPC與mHSPC,但健保給付的適應症僅有nmCRPC2。根據第三期臨床試驗顯示,Darolutamide可延長無轉移存活期(metastasis-free
survival, MFS)達 40.4 個月,並降低整體死亡風險31%3。至今,有關Darolutamide國內外實證仍相當缺乏。本研究的目的在評估北部某醫院多院區病人,實際使用Darolutamide的適應症、劑量及治療相關副作用。
貳、 研究對象與方法
本研究已取得某醫學中心倫理審查委員會審核通過證明(案號:202301189B0)。採病歷回顧方式進行回溯性研究,透過本院建置的醫療資訊系統(Hospital
Information System,
HIS),蒐集2022年8月16日至2023年2月15日六個月期間至某醫院北部五院區就診且初次使用Darolutamide的病人為研究樣本,後續追蹤至2023年8月15日,進行處方適當性及藥品安全性評估。記錄期間病人的基本資料,包括性別及首次使用的年齡。處方適當性則評估使用Darolutamide的適應症、劑量及併用藥物。安全性部份,針對停用Darolutamide的原因分析及記錄後續更改的藥品。
參、結果
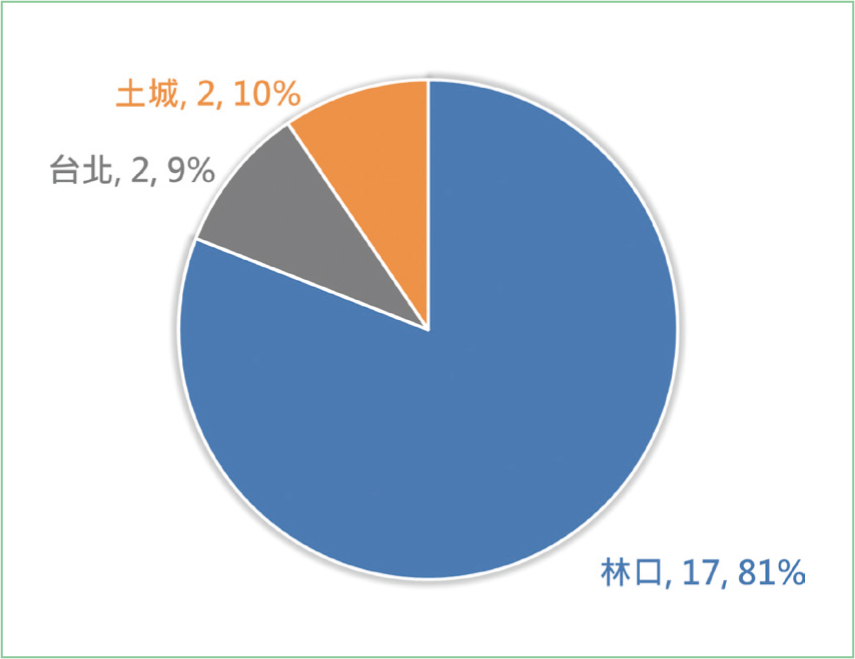
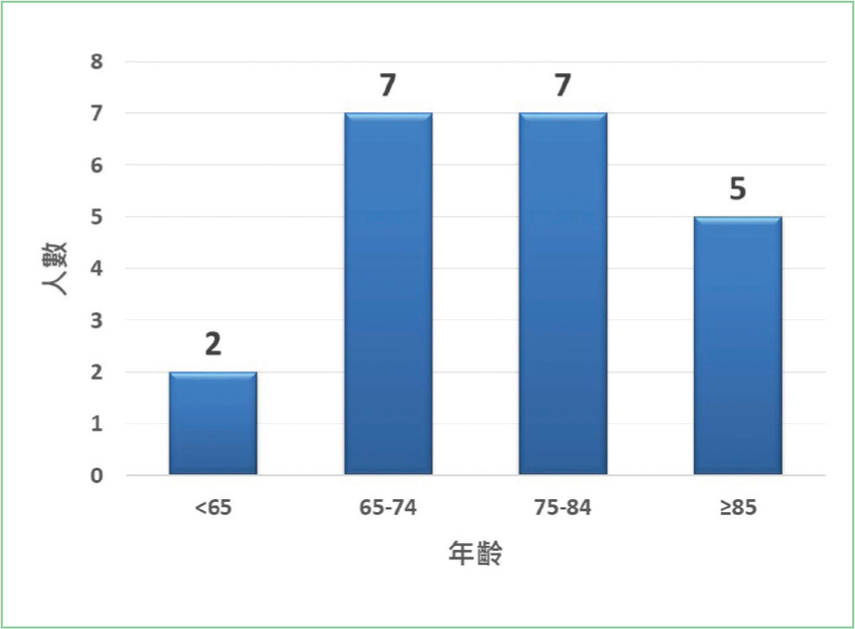
自2022年8月16日至2023年2月15日初次使用Darolutamide的病人有21位,主要分布於林口院區,台北院區與土城院區各有兩位病人(圖一)。由於前列腺癌的疾病特性,研究對象中,全數皆為男性。大約九成病人為65歲以上老年人,平均病患年齡為75.5歲(圖二)。21位病患中,
14位的適應症是非轉移性去勢抗性前列腺癌(nmCRPC),為符合衛生福利部健保給付且通過事前審查申請用藥;衛福部仿單核准適應症外使用(off-label
use)共7位的病人,為自費開立,適應症為已轉移的前列腺癌。截至2023年8月15日止,所有病人平均用藥天數為212.4天(14-364天)。根據仿單,Darolutamide
的劑量為每日兩次600 mg,對重度腎功能不全(腎絲球過濾率估計值 [eGFR] 15至29
mL/min/1.73 m2)且未接受過透析治療的病人或中度肝功能不全(Child-Pugh
B)的病人,建議調整劑量為每日兩次300 mg;在血液透析或重度肝功能不全(Child-Pugh
C)的病人中,Darolutamide的藥物動力學資料有限。21位病人中有一位在血液透析且為自費使用,開方劑量為300
mg 每日一次,其餘病患劑量皆為600 mg 每日兩次。
圖二 病人年齡分布
根據美國國家癌症資訊網 (National Comprehensive Cancer
Network, NCCN)於2023年發佈的前列腺癌治療指引,nmCRPC會透過手術或皮下注射全身性荷爾蒙藥物來維持雄性荷爾蒙濃度,達去勢濃度<50
ng/dL,稱為雄激素剝奪療法(androgen deprivation therapy,
ADT)。研究對象中,除了一位(5%)接受睪丸切除術(orchiectomy),其餘(95%)皆透過每3個月施打促性腺激素釋放荷爾蒙致效劑
(gonadotropin-releasinghormone agonist, GnRH
agonist)維持雄性賀爾蒙在去勢濃度。使用的GnRH的藥品有Leuprorelin(43%)、Goserelin(52%)兩種。
安全性部分,以治療相關的不良事件(treatment related adverse
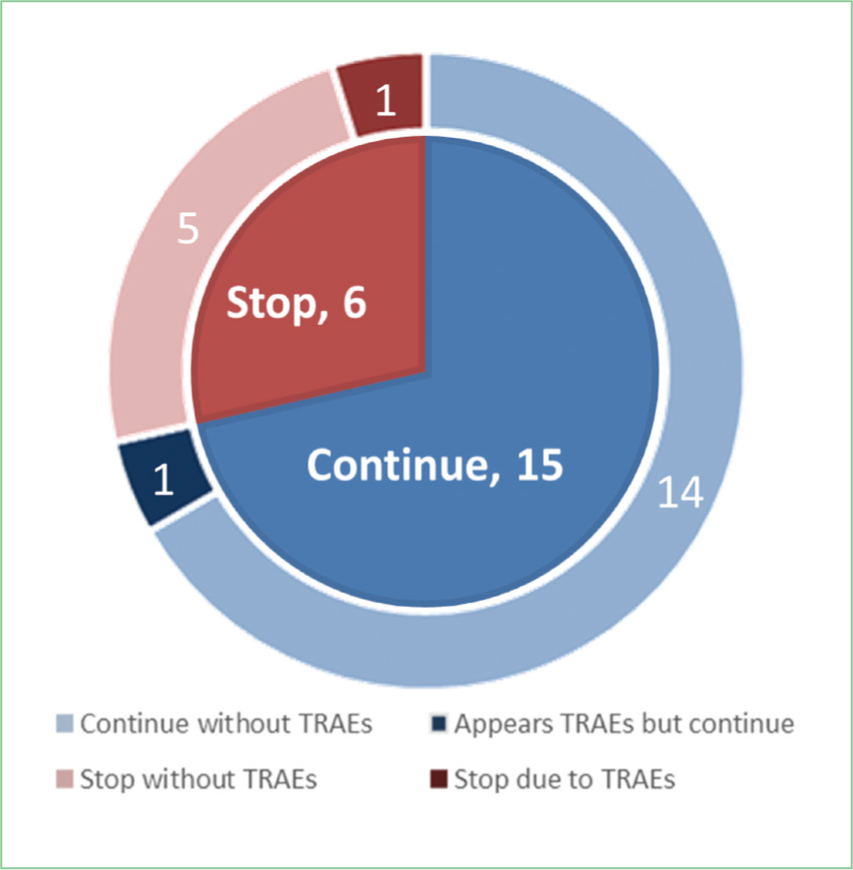
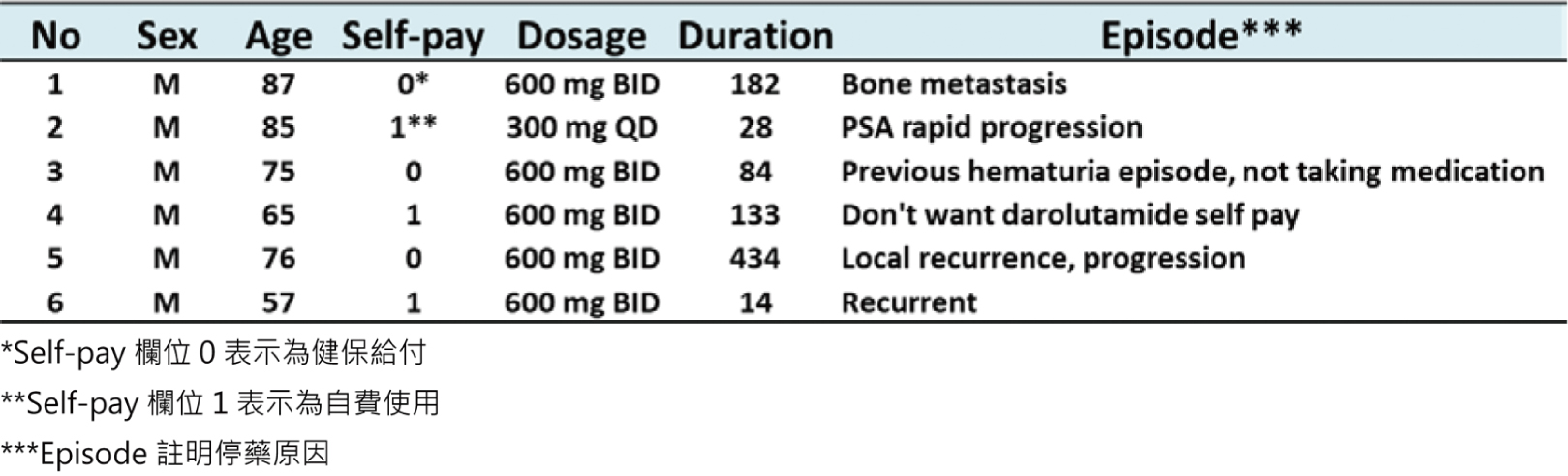
effects, TRAEs)來呈現。觀察期間僅2位病患出現不良反應,一位出現血尿,另一位則出現呼吸道感染與嚴重程度第二級副作用腹瀉。開立止瀉藥與暫停Darolutamide後,副作用緩解後續繼續使用Darolutamide並未再出現相同不良反應。21位病患中無人出現嚴重程度三級以上的重度TRAEs。試驗期間共有6位病人停止使用Darolutamide(圖三),平均年齡74.2歲,平均用藥天數145.8天,一半是自費的病患(表一)。6位停藥的病患中,有4位是因為疾病進展,效果不佳而停藥;
1位因出現血尿後無繼續回診;1位自費病人控制良好但因經濟負擔考量,不想繼續自費Darolutamide,改申請符合健保給付的Abiraterone。停藥的試驗對象中,有兩位改用雄性素生合成的抑制劑(androgen
biosynthesis inhibitor)Abiraterone。除上述因經濟考量改用健保給付藥品之病患外,另一位則因疾病進展,故改用符合轉移性攝護腺癌適應症的用藥Abiraterone。
肆、討論
一、 選擇Darolutamide的考量
在攝護腺癌的疾病進展中,nmCRPC是一個特殊的狀態,通常在用荷爾蒙藥物控制雄性激素濃度的狀況下,攝護腺特定抗原(prostate-specific
antigen, PSA)數值會趨向穩定,疾病進展也會獲得控制。而nmCRPC則是體內雄性激素已達到去勢濃度時,PSA依然急遽上升,且無影像證據顯示轉移1。在Apalutamide的SPARTAN臨床試驗中,將nmCRPC病人PSA倍數成長時間<10個月者,定義為高風險的nmCRPC4。這個定義後來也被Enzalutamide與Darolutamide兩個第二代抗雄性素受體阻斷劑的研究延續使用,健保給付規定中,也是以10個月作為標準。根據NCCN治療指引,nmCRPC的病人如果PSA倍數成長時間<10個月者,除了ADT外,還須加上新型口服荷爾蒙藥物治療。SPARTAN試驗成功證明在nmCRPC的治療中抗雄性素受體阻斷劑搭配ADT,相較僅用ADT治療,延長無轉移存活期達四十個月,同時降低整體死亡風險22%4。在Enzalutamide的PROSPER試驗中,也證實了合併ADT治療,可以延長無轉移存活期三十六個月,並降低整體死亡風險27%5。Darolutamide是最新研發的第二代抗雄性素受體阻斷劑。在ARAMIS試驗中證實,合併ADT治療延長無轉移存活期達四十個月。另外,因為結構上的特殊性,較不易滲透的腦血管屏障,相較其他藥物,副作用較低6。
考量到攝護腺癌的病人年齡層偏高,有較多慢性,服用藥物種類也偏多。Darolutamide、Apalutamide與Enzalutamide的藥物交互作用也會是選擇藥物的考量重點。Apalutamide與Enzalutamide跟屬於細胞色素P450(cytochromes
P450, CYP)3A4、CYP2C9和
CYP2C19受質的藥物會產生較強的交互作用,降低其他藥物的效果,而Darolutamide與前述受質無交互作用7,8。根據加拿大泌尿外科協會(Canadian
Urological Association)整理常見藥品與ARis的藥物交互作用。相對於Darolutamide僅被列出與8種藥物有交互作用,Apalutamide與Enzalutamide跟多達八十種藥物有不同程度的交互作用,其中禁止併用的藥品分別有13和31種。
根據健保給付規定,治療nmCRPC時,Darolutamide與Apalutamide僅能擇一使用,且不可互換。但若屬嚴重藥品副作用耐受性不佳者,不在此限2。此次研究對象中,因病情進展,在Darolutamide引進院區使用前,有八位病患有使用其他種ARi,其中有六位使用Apalutamide,並都因嚴重程度不一的皮膚搔癢與紅疹的TRAEs停藥,改用Darolutamide。這個情況與在SPARTAN試驗中發現,Apalutamide有較高的機率引起皮疹的副作用相符4。另一方面,PROSPER試驗中有證實Enzalutamide對於nmCRPC也有顯著的效果5。研究期間,健保給付該藥物用於高風險轉移性去勢敏感性攝護腺癌病人與轉移性去勢抗性攝護腺癌,但並未給付於nmCRPC病人
(自112年9月1日起,健保給付Enzalutamide用於nmCRPC)。換句話說病人需要自費使用。綜合以上原因,如果擔心Apalutamide皮膚相關的副作用發生率較高,加上藥物交互作用的考量,Darolutamide是個可優先考慮的選擇。
二、 Darolutamide與轉移性的去勢抗性前列腺癌
根據NCCN治療指引,轉移性去勢抗性前列腺癌(metastatic
castration-resistant prostate cancer, mCRPC)會合併鐳223治療、紫杉醇(taxane)類化學治療與口服荷爾蒙藥物。目前衛福部核可的口服荷爾蒙藥物有Abiraterone和Enzalutamide,在治療mCRPC上,Apalutamide與Darolutamide並非符合目前健保給付規定的治療選項。Egils
Vjaters等學者在ARAMIS臨床試驗後,以mCRPC病人為研究主體,有做一個小型的Darolutamide長期使用耐受性試驗。探討病人連續使用藥物大於兩年的不良反應。試驗結果發現,Darolutamide長期使用且沒有出現第四級以上嚴重程度的不良反應,僅五位病患出現嚴重程度第一級的TRAEs9。Silke
Gillessen學者曾執行紫杉醇(taxane)類化學治療,使用Darolutamide做維持治療的療效與安全性研究中發現:使用Darolutamide有更低的死亡風險與較輕微的副作用,提高了病人的可接受性與生活品質。未來可以透過更大型的試驗,來驗證是否可以是mCRPC的新治療選擇10。
在此次收錄的21位試驗對象中,有7位因為不符健保給付而自費使用Darolutamide。其中,一位是骨轉移的mHSPC病人;四位是mCRPC的病人(2位骨轉移,2位遠端淋巴轉移);其餘兩位是骨轉移,但病歷未載明為何種類型的轉移性攝護腺癌。就疾病的控制而言,有兩位分別因PSA快速上升或淋巴轉移復發控制不佳而停藥,餘下五位在Darolutamide使用下都控制良好。雖然目前證據有限,本次試驗結果Darolutamide可以有效控制部分病人的病情。同類型的ARi
Enzalutamide 在治療mHSPC與mCRPC上有獲得衛生福利部核可的適應症,學理上也可以考慮是治療nmCRPC的另一個選擇。在nmCRPC與mHSPC獲得衛生福利部核可的適應症,副作用的部分較可接受的Darolutamide,也許在更多的臨床試驗後,也有機會使用在mCRPC的治療上。
伍、 結論
此次研究針對Darolutamide的藥品使用評估,主要使用於非轉移性的去勢抗性前列腺癌。期間無病人出現嚴重不良反應,除了一位洗腎病人,因仿單缺乏洗腎相關劑量研究,使用Darolutamide
300 mg每日一次,其餘病人皆使用仿單建議劑量600
mg每日兩次。在一年的研究期間,全體病人平均用藥天數為212天,顯示於本院臨床使用Darolutamide於前列腺癌的控制,相較於文獻提及與本院病人先前使用Apalutamide常因皮膚相關副作用停藥,使用Darolutamide之病人於本次研究中較少因無法耐受副作用而停藥。於衛福部仿單核准適應症外使用在轉移性的前列腺癌,雖無核准適應症但有期刊文獻佐證,且臨床控制良好。我們的研究結果顯示Darolutamide用於前列腺癌的控制,病人耐受性良好,且未發生嚴重藥物相關不良反應。
Darolutamide Use
Appropriateness
Assessment and Its Drug-Related Problems
Chia-Lin Li, Hui-Yu Chen, Tzu-Cheng Tsai, Li-Huei
Chiang
Department of Pharmacy, Chang Gung Memorial
Hospital
Abstract
Darolutamide is the latest second-generation
androgen receptor inhibitor. Comparing to other
ARis, it has higher affinity and fewer side
effects due to its unique structure. During the
study period, the only indication approved by
the Ministry of Health and Welfare is non-metastatic
castration-resistant prostate cancer. This study
aims to investigate the clinical use of
darolutamide and to ensure the rationality and
safety of the drug in a multi-center hospital in
the north Taiwan. We analyzed the clinical use
of darolutamide during the six-month period
(August 16, 2022 to February 15, 2023). Fourteen
patients (66.7%) were used to treat non-metastatic
castration-resistant prostate cancer; 7 patients
(33.3%) used off-label use: metastatic
hormone-sensitive prostate cancer (n=1),
metastatic castration-resistant prostate cancer
(n=4) and two metastatic prostate cancers of
unspecified type. Among them, metastatic
hormone-sensitive prostate cancer has been
approved by the Ministry of Health for
indications after the study period, while
metastatic castration-resistant prostate cancer
has scientific evidence to support its efficacy.
The safety section is presented as
treatment-related adverse events (TRAEs). Two
patients had hematuria, respiratory infection,
or diarrhea. This results shows that
darolutamide was well tolerated and no serious
adverse drug reactions occurred.
參考資料:
1. Joelle El-Amm and Jeanny B Aragon-Ching: The
Current Landscape of Treatment in Non-Metastatic
Castration-Resistant Prostate Cancer. Clinical
Medicine Insights: Oncology. 2019; Volume 13:
1–5
2. 衛生福利部中央健康保險署 藥品給付規定
3. Karim Fizazi, Neal Shore, Teuvo L. Tammela,
et al: Nonmetastatic, Castration-Resistant
Prostate Cancer and Survival with Darolutamide.
N Engl J Med 2020;383:1040-9.
4. Matthew R. Smith, Fred Saad, Simon Chowdhury,
et al: Apalutamide Treatment and Metastasis-free
Survival in Prostate Cancer. N Engl J Med 2018;
378:1408-18.
5. Maha Hussain, Karim Fizazi, Fred Saad, et al:
Enzalutamide in Men with nmCRPC. N Engl J Med
2018; 378:2465-74.
6. Karim Fizazi, Neal Shore, Teuvo L. Tammela,
et al: Darolutamide in Nonmetastatic,
Castration-Resistant Prostate Cancer. N Engl J
Med 2019;380:1235-46.
7. Ulrich M Zanger 1, Miia Turpeinen, Kathrin
Klein, et al: Functional pharmacogenetics/genomics
of human cytochromes P450 involved in drug
biotransformation. Anal Bioanal Chem. 2008
Nov;392(6):1093-108.
8. Neal Shore, Christian Zurth, Robert Fricke,
et al: Evaluation of Clinically Relevant
Drug–Drug Interactions and Population
Pharmacokinetics of Darolutamide in Patients
with Nonmetastatic Castration-Resistant Prostate
Cancer: Results of Pre-Specified and Post Hoc
Analyses of the Phase III ARAMIS Trial. Target
Oncol. 2019; 14(5): 527–539.
9. Egils Vjaters, Karim Fizazi, Nicholas D.
James, et al: Long-term safety of darolutamide
in patients with metastatic castration-resistant
prostate cancer. Journal of Clinical Oncology
40, no. 6_suppl 90-90.
10. Silke Gillessen, Giuseppe Procopio, Stefanie
Hayoz, et al: Darolutamide Maintenance in
Patients With Metastatic Castration-Resistant
Prostate Cancer With Nonprogressive Disease
After Taxane Treatment (SAKK 08/16). J Clin
Oncol 2023; 41:3608-3615
通訊作者:江俐慧/電子信箱:lindseychiang@gmail.com