疾病調節抗風濕藥物對於
類風濕性關節炎的治療綜論
陳于真
秀傳醫療社團法人秀傳紀念醫院藥學部
摘要
類風濕性關節炎是一種自體免疫疾病,不僅是關節的慢性發炎,身體的其他組織和器官都會受到影響。早期的診斷與治療是避免關節破壞導致失能的重要關鍵。其中藥物治療又以疾病調節抗風濕藥物的治療角色最為重要。疾病調節抗風濕藥物,除了傳統化學合成的藥物之外,由於生物技術的發展,目前還有小分子口服標靶藥物及生物製劑可提供作為治療的選擇。多種疾病調節抗風濕藥物,其治療策略仰賴專家的經驗分享,而美國風濕病協會與歐洲抗風濕病聯盟分別於2021及2022發表相關的治療指引與建議;本文主要就近期的相關文獻討論疾病調節抗風濕藥物針對類風濕性關節炎的治療策略與選擇。
關鍵字: 類風濕性關節炎、疾病調節抗風濕藥物、DMARDs、標靶藥物、生物製劑
壹、前言
類風濕性關節炎(rheumatoid arthritis,
RA)是一種全身性的自體免疫疾病,是發炎性關節炎疾病中最盛行的關節炎疾病。在發展中國家,RA的盛行率大約是0.5-1%;而女性的罹病率約是男性的2-3倍,發病年齡主要在30-50歲之間1;類風濕性關節炎患者,關節的持續疼痛,若未在發病初期妥善控制,患者很可能發生關節破壞而逐漸變形,嚴重將造成不可逆的失能後果。
RA的藥物治療,主要以NSAIDs(non-steroidal
anti-inflammatory
drugs)和類固醇作為症狀的緩解;疾病調節抗風濕藥物(disease-modifying
antirheumatic drugs, DMARDs),在一診斷為類風濕性關節炎時,就應該以其作為治療的主線藥物,以避免關節持續性的發炎損壞2。隨著生物技術發展,RA的患者除了傳統DMARDs之外,增加了許多生物製劑及口服標靶藥物供治療的選擇。
本文將就最近期的指引、建議及相關文獻,一同討論疾病調節抗風濕藥物在類風濕性關節炎的治療地位,以及目前治療策略的思維及選擇藥物上的考量。
貳、類風濕性關節炎的症狀、診斷與藥物治療概況
RA初期的常見症狀與其他的發炎性關節炎並無明顯差異,主要的常見症狀為晨僵、疲勞、關節疼痛與腫脹。常見於雙側的手腕、手指、膝蓋、腳踝等關節。持續性地關節慢性發炎,除引起關節部位的紅腫熱痛之外,骨頭的破壞會造成關節結構變形甚至是永久性的功能喪失。雖然關節發炎是典型的症狀,但其實全身的組織和器官都會被影響3。
依據2010美國風濕病協會(American College of Rheumatology,
ACR)及歐洲抗風濕病聯盟(European League against
Rheumatism, EULAR)聯合發表的診斷標準所訂定的準則4,診斷需透過四項指標來評估:一、關節受影響的部位與數目;二、症狀持續時間(是否持續6週以上);三、血清學,類風濕性因子(rheumatoid
factor)或/和抗環瓜氨酸抗體(anti-cyclic citrullinated
peptide antibody)的血中濃度;四、發炎指數,CRP(C-reactive
protein)或/和ESR(erythrocyte sedimentation
rate)的數值高低,若患者達到6分以上(總分10分),即可歸類為罹患類風濕性關節炎。
另外,類風濕性關節炎的疾病活動度的評估,則是以DAS28指數(disease activity
score by 28
joints),評估特定關節的壓痛及腫脹數目、ESR檢測數值以及患者自我健康狀態評分,來做為藥物治療成效的評估指標。透過特定公式來計算DAS28的總積分,分數越高,代表病情越不佳。DAS28<2.6,是病情緩解
(remission);介於2.6-3.2是低度關節疾病活動度 (low disease
activity);介於3.2-5.1是中度關節疾病活動度(moderate disease
activity);>5.1則是高度關節疾病活動度(high disease activity)3。而ACR反應指標
(ACR Response
Criteria)是另一種常用來評估用藥之後疾病症狀改善情形,除了28個關節的症狀改善程度外,還有患者自我評估及醫師的評估,以及疼痛指數、活動力、發炎指數等評估指標。ACR20、50、70分別代表評量指標其中三項改善幅度達20%、50%、70%3。
目前的藥物治療主要以NSAID和類固醇來立即緩解疾病的症狀;DMARDs的治療地位,除了可以舒緩關節的腫脹和疼痛,主要作為減緩疾病病程的主線藥物,改善患者的生活品質及避免關節的破壞造成未來失能的情況2。
參、疾病調節抗風濕藥物的簡介
疾病調節抗風濕藥物,除了傳統合成的藥物(conventional synthetic
DMARDs, csDMARDs)之外,目前還有生物製劑(biologic DMARDs,
bDMARDs)以及小分子標靶口服藥物(targeted synthetic DMARDs,
tsDMARDs)可供選擇5,6。
一、 Conventional synthetic DMARDs(csDMARDs)
依據ACR的建議,csDMARDs常用於治療RA的有methotrexate (MTX)、sulfasalazine
(SSZ) hydroxychloroquine (HCQ)以及leflunomide
(LF)。
二、 Biologic DMARDs(bDMARDs)(如表一)
治療類風濕性關節炎的生物製劑,主要是透過抑制免疫細胞或細胞激素來減緩發炎反應。
表一 核准用於類風濕性關節炎的生物製劑 (整理自相關藥品仿單)
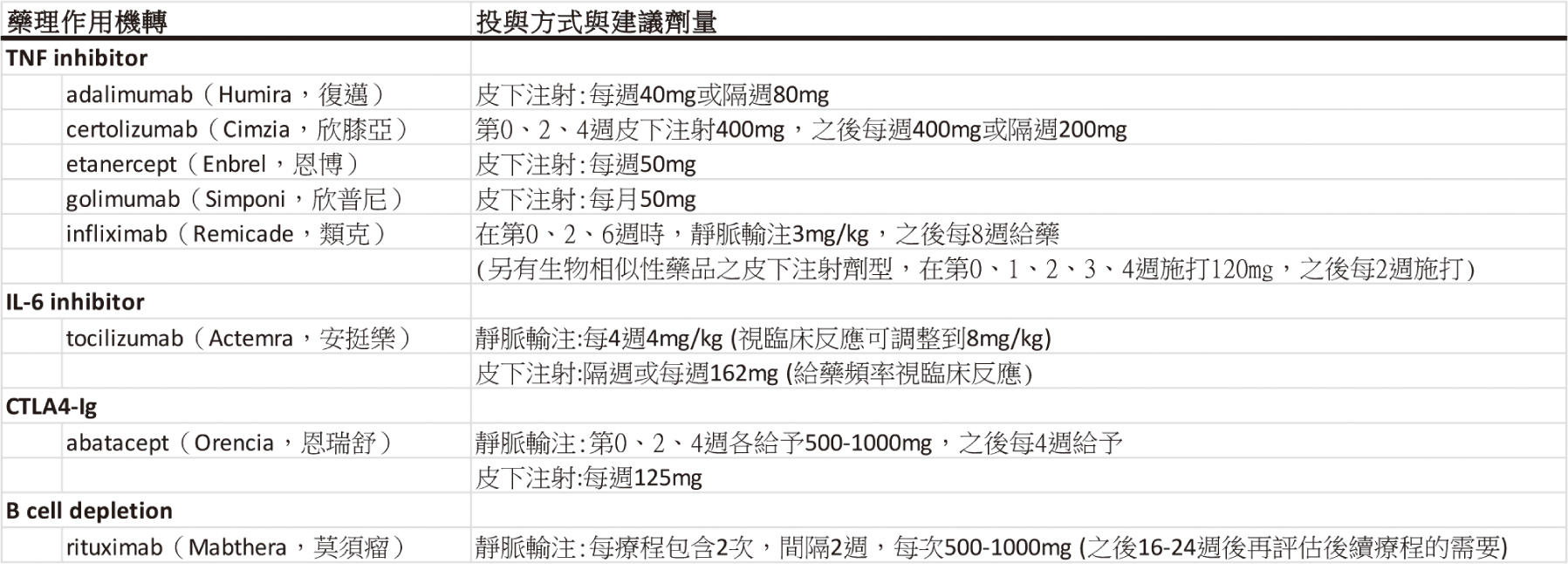
(一)目前共計有5種腫瘤壞死因子抑制劑(tumor necrosis factor
inhibitor, TNFi),包括adalimumab(Humira,
復邁)、certolizumab(Cimzia, 欣膝亞)、etanercept(Enbrel,
恩博)、golimumab(Simponi, 欣普尼)、infliximab(Remicade,
類克)。
(二)台灣目前核准其他機轉,非透過抑制腫瘤壞死因子的生物製劑,包括tocilizumab(Actemra,
安挺樂)、abatacept(Orencia, 恩瑞舒)、rituximab(Mabthera,
莫須瘤)。
1. Tocilizumab可以透過每4週靜脈輸注或隔週皮下注射的方式,與interleukin-6
(IL-6)的接受器結合,抑制與IL-6有關的免疫反應,包括T細胞、B細胞、巨噬細胞和蝕骨細胞的活化7。
2. Abatacept是cytotoxic T-lymphocyte-associated
antigen 4
(CTLA4)細胞毒性T淋巴球相關抗原4的融合蛋白,透過每個月的靜脈輸注或每週的皮下注射,以負向回饋的方式調控作用型T細胞(T
effector cell)相關的免疫反應8。
3. Rituximab,是針對B細胞上CD
20標誌的單株抗體,以靜脈輸注方式給藥,與B細胞結合之後,會引起細胞毒殺和細胞凋亡,造成B細胞的消耗(B
cell depletion)7。
目前生物製劑中,參考台灣藥品許可證查詢系統,已有生物相似藥(biosimilar)可供選擇的有下列成分:adalimumab、rituximab、etanercept、infliximab。
三、 Targeted synthetic DMARDs(tsDMARDs)
指的是小分子標靶口服藥物,Janus kinase inhibitor(JAKi)。JAK屬於tyrosine
kinase;當細胞激素與JAK位於免疫細胞表面的部份結合,繼而引發JAK及一連串的激酶活化,促使與免疫細胞增生、分化和細胞激素的生成有關的細胞轉錄作用。JAKi可以阻止發炎和免疫反應的進行。台灣目前有tofacitinib(Xeljanz,
捷抑炎)、baricitinib(Olumiant,
愛滅炎)、upadacitinib(Rinvoq,
銳虎)、peficitinib(Smyraf,
施覓福)、filgotinib(Jyseleca, 吉炎可);除了tofacitinib為非選擇性的JAKi,其他的藥物能選擇性抑制不同的JAK(Janus
kinase)。
肆、治療指引與建議9, 10
EULAR自2010年開始有關於DMARDs在RA患者治療上的建議;平均每三年會更新一次,EULAR最近期是在2022年有更新版,而ACR的相關指引則有2021年的更新版。
一、關於治療策略的思維
達標治療(treat-to-target),主要是指積極監測 (tight
control)藥物治療是否達到治療目標,即病情緩解或維持在低度關節疾病活動度
(指DAS28在3.2或2.6以下)持續時間達6個月。療效的評估區間,建議應每1~3個月評估一次;最多3個月若症狀沒有改善,或6個月沒有達到治療目標,則建議修正藥物治療策略。
二、DMARDs起始治療的選擇
(一)csDMARDs與bDMARDs和tsDMARDs相較之下,嚴重感染的風險較低,而在不同的臨床試驗比較MTX與其他csDMARDs治療RA的效果,低劑量的MTX
(7.5-25
mg/週)除了可以減輕症狀、減緩發炎,還能避免關節的骨頭侵蝕,應該在診斷確立的時候,就開始使用,除了懷孕或有懷孕、哺乳考量的患者、嚴重腎功能不全及飲酒習慣的患者之外,MTX是csDMARDs中的首要選擇5。
(二)其他的csDMARDs中,在療效上,LF (一天一次 20 mg)相較之下優於SSZ
(每日1-3 g)11;HCQ (每日200-400
mg)以往由於副作用耐受性好而廣泛使用12,但曾有研究比較HCQ與SSZ對於減緩關節損壞的效果上,有明顯的差異,HCQ就減緩關節破壞以延緩疾病進程上,屬於效果較弱的DMARDs13,因而建議無法使用或無法耐受MTX的中重度疾病活動度的患者可以LF或SSZ做為起始治療的替代藥物;患病早期的輕度患者,則可以使用HCQ11。
(三)若有MTX的使用禁忌,csDMARDs中SSZ及HCQ可安全使用於懷孕哺乳中的患者;仍須注意的是,懷孕期間使用SSZ,使用劑量需小於2
g及補充葉酸,並留意患者是否授乳於早產兒、生病或G6PD缺乏症的嬰兒14。由於MTX主要經由腎臟代謝,當eGFR
< 30 mL/minute,禁止使用,而LF在腎功能不全的患者不需調整劑量,SSZ對於中度腎功能不全的患者,建議由最低建議劑量開始使用並逐漸調整,每日劑量不超過3
g。肝功能不佳的患者,MTX須減量或避免使用,LF也不建議用在肝功能不全的患者,SSZ及HCQ則不需調整劑量11。
三、類固醇的使用
(一)由於csDMARDs使用一段時間,療效才會逐漸發揮,所以建議開始使用csDMARDs或劑量調整、使用途徑更改等時,短時間(3個月)併用類固醇作為橋接治療(bridging
therapy),在DMARDs產生療效之前,先緩解症狀。情況允許的話,類固醇建議逐漸減量至停用。若類固醇無法作減量或停止使用,代表現行使用的DMARDs需要作調整。
(二)開始使用bDMARDs或tsDMARDs即可停用類固醇,因為併用會增加感染的機率。
四、當使用csDMARDs無法達到治療目標
下一階段治療的分水嶺是評估病患是否具有造成預後不佳的因素(poor prognostic
factor)註。沒有造成預後不佳因素的患者,持續選擇合併使用csDMARDs治療;若有,建議在原有治療組合中,開始使用bDMARDs或tsDMARDs。
註:造成RA預後不佳的因素包括rheumatoid factor或anti-cyclic
citrullinated peptide
antibody的存在與否、關節疾病活動度是否為高度、關節骨頭是否有損壞跡象或使用2種以上的csDMARDs仍未達治療目標。
五、選擇bDMARDs或tsDMARDs的考量:
(一)TNFi通常作為優先選擇,主要由於臨床使用經驗相較於其他機轉的生物製劑及小分子標靶口服藥物較多11;目前沒有直接的證據證實哪一種TNFi的療效最好。其中TNFi中透過非直接性的比較,etanercept相較adalimumab及infliximab,其發生嚴重感染的機率似乎較低11。Certolizumab是TNFi中唯一健保不限制孕哺期婦女患者使用的生物製劑14。Golimumab,只需每月施打一次。TNFi與MTX的合併治療,效果都優於MTX或生物製劑單獨使用11。若需採用單一治療時,不建議以infliximab做為選擇,因為其屬於人鼠嵌合的單株抗體藥品,隨著時間人體會產生對抗藥品的抗體導致療效降低11。
安全性上的考量,使用TNFi除增加伺機感染風險,亦會增加結核分枝桿菌及病毒感染或再活化的風險,且可能會造成血球減少以及出現自體免疫的相關症狀,包括血管炎、藥物引起的紅斑性狼瘡、脫髓鞘疾病、肝毒性等。相較之下,目前長短期的研究都沒有顯示會增加惡性腫瘤的風險。TNFi禁止使用於多發性硬化症及失償性心臟衰竭15。
(二)Abatacept,臨床試驗證實單一治療的療效與MTX相當;與MTX的合併治療效果優於MTX單獨使用11;對MTX或TNFi反應不佳的患者皆具有療效。就安全性上,也會增加嚴重感染的機率,但整體上並沒有比TNFi來的高;沒有顯示會增加惡性腫瘤的風險;靜脈輸注劑型需留意輸注反應;而在臨床試驗中觀察到,對於有慢性呼吸道阻塞的患者,使用abatacept相較之下有較高的發作和肺部感染的比例15,16。
(三)Anti-IL6中的tocilizumab,臨床試驗的結果顯示,以8
mg/kg靜脈輸注,無論是單獨使用 (RR 2.00, 95% CI 1.59-2.51)或與MTX併用
(RR 1.86, 95% CI 1.48-2.32),其療效都顯著優於以MTX單獨治療的療效11。對於MTX反應不佳的RA患者,以tocilizumab治療,與
TNFi中的adalimumab相比能顯著減少DAS28 (-1.5, 95% CI -1.8
to -1.1)16。安全性上的考量,除了有可能造成嚴重感染,也可能會導致血球減少、肝指數上升,當嗜中性球
<2000/mm3或血小板<100,000/mm3或肝指數大於正常值上限的1.5倍時,應避免使用;另外也可能會造成血脂異常,但目前並沒有發現有增加心血管事件的風險;憩室炎的病史則為禁忌症15。
(四)Rituximab,目前並沒有與其他生物製劑相關的比較研究,但對於以MTX合併TNFi治療效果不佳,相較於再使用TNFi中的其他藥物,rituximab可以提供更好的治療效果16。
(五)tsDMARDs皆為口服藥物,目前沒有臨床試驗直接比較不同tsDMARDs,而以間接的研究方式比較這5種藥物,其治療效果沒有顯著差異16。但就單一臨床試驗的結果,tofacitinib
(每日2次5 mg或10 mg)、baricitinib (每日4
mg)、upadacitinib (每日15或30 mg),其單獨使用與MTX相比,其療效較MTX為佳;使用MTX無法達到治療目標的患者,與MTX合併治療的療效比較,tofacitinib與adalimumab相當;baricitinib、upadacitinib則優於adalimumab15。Tofacitinib的使用經驗較多,通常是此類藥物的優先選擇15。安全性上的考量,由於臨床試驗中除了也會增加嚴重感染、肝功能異常、血球減少、血脂異常的機率之外,使用tofacitinib相較於TNFi有較高的機率出現心血管事件、肺栓塞、靜脈栓塞及惡性腫瘤,所以使用tsDMARDs此類藥物時需考量相關的風險因子(risk
factor),如年齡大於50歲及是否有其他心血管風險因子等,衡量藥物使用的利與弊。由於安全性的考量,目前美國FDA建議在TNFi治療反應不佳再使用tsDMARDs15。
(六)使用bDMARDs或 tsDMARDs療效不佳,雖然可以選擇不同機轉或相同機轉的藥品治療,但TNFi相關的研究發現,治療反應不佳後再選擇相同機轉的藥品,可能會出現療效下降,建議使用不同機轉的藥品16。
伍、 生物製劑及小分子標靶口服藥物的健保給付規範
考量bDMARDs或tsDMARDs的使用時機,若以健保方式開立,必須依照免疫抑制劑相關給付規定:依照ACR準則,為高度疾病活動度狀態,以csDMARDs充分治療仍無明顯療效。無明顯療效是指DAS28總積分下降<1.2或總積分>3.2。充分治療,是指2
種藥物合併治療至少6個月,且其中至少2個月DMARDs的劑量須達規定的標準目標劑量;若同時合併prednisolone
(15 mg/天)治療,則併用藥物治療至少3個月,且DMARDs的劑量也必須達規定的標準目標劑量至少2個月;若是在無法忍受藥物副作用的情形下,DMARDs的合併使用劑量必須達治療劑量連續2個月以上。須事前審查核准後使用,除infliximab施打療程的關係有所不同,一般使用半年後需每3個月再申報一次。csDMARDs標準目標劑量及治療劑量參考全民健保給付規定之附表十四,如表二。
表二 全民健保給付規定csDMARDs之標準目標劑量及治療劑量

陸、疾病修飾抗風濕藥物的副作用和注意事項探討
使用DMARDs治療前,須先進行全血球計數、肝腎功能評估,病毒性肝炎及潛伏性肺結核的篩檢並接受相關疫苗的施打及治療期間定期監測感染徵兆,再依據個別藥物做副作用的監測,在安全的前提下提供患者有效的治療。
依據UpToDate的相關藥物資訊,靜脈輸注劑型的藥物,須留意輸注反應。csDMARDs中,若要開始使用MTX治療,則建議進行胸部X光檢查,由於大部分的患者會出現腸胃道不適,使用期間建議補充葉酸,也必須監測對於骨髓抑制、肝腎毒性和肺部的傷害。SSZ除了會造成皮膚和尿液變色,還必須注意是否有出現過敏及葉酸缺乏的情形。視網膜病變是使用HCQ的禁忌症,期間也須定期監測視力,也可能會加重重症肌無力患者的病情,另一方面與SSZ一樣,對於G6PD缺乏症的患者會有造成溶血性貧血的風險。SSZ、HCQ及leflunomide,在使用期間也都必須留意骨髓抑制、肝腎功能的變化。
柒、結語
DMARDs的選擇上,依現行的指引、建議作為參考以及健保給付的規範下,考量包括患者的疾病的嚴重度、共病(肝腎疾病、感染性疾病、心血管疾患、肺部疾患、患惡性腫瘤的風險等)、生育的規劃、治療階段、投予途徑及經濟層面的考量,在患者充分了解藥物治療相關的療程、安全與副作用,由醫病共同決策。
The Treatment Strategy of Disease-modifying
Antirheumatic Drugs for RheumatoidArthritis
Yu-Chen, Chen
Department of Pharmacy, Show Chwan Memorial
Hospital
Abstract
Rheumatoid arthritis (RA) is an autoimmune
disease that not only results in disruption of
joint structure and function but also impacts on
the whole body. The key factor to preserve
physical function of the joints is the
aggressive treatment of disease-modifying
anti-rheumatic drugs (DMARDs) in the early phase
of the disease. Over the past two decades, the
advance in biotechnology has introduced the new
therapeutic agents, including biologic DMARDs
and targeted synthetic DMARDs, as effective
therapeutic interventions. Patients with
established RA typically require continuous drug
administration of DMARDs to control disease
activity. Accordingly, the American College of
Rheumatology and the European League Against
Rheumatism released related update guidelines
and recommendations of DMARDs on treatment of
rheumatoid arthritis in 2021 and 2022. The main
purpose of this article is to elucidate the
strategy of DMARDs treatment for rheumatoid
arthritis.
參考資料:
1. Kayla M.Carr, Kylie Lucas, Glenn R: A review
of rheumatoid arthritis for pharmacists. U.S.
Pharm. 2022;47(11):36-71.
2. Larry W Moreland, Amy Cannelia: General
principles and overview of management of
rheumatoid arthritis in adults. In UpToDate
(last updated on Mar 7, 2023).
3. 唐正乾、吳文生:類風濕關節炎的生物製劑療法。家庭醫學與基層醫療
2019;34(8):234-240。
4. Jonathan K, Katherine S U: ACR/EULAR 2010
rheumatoid arthritis clarification criteria.
Rheumatology 2012;51:vi5-vi9.
5. Stanley Cohen, TedR Mikuls: Initial treatment
of rheumatoid arthritis in adults. In UpToDate
(last updated on Jan 5, 2024).
6. Eduardo M, Mariana C, Ana L: Current and
emerging DMARDs for the treatment of rheumatoid
arthritis. Open Access Rheumatol.
2021;13:139-152.
7. Gerd R Burmester: Overview of biologic agents
in the rheumatic disease. In UpToDate (last
updated on Jan 11, 2024).
8. Alexander N Shoushtari: Principles of cancer
immunotherapy. In UpToDate (accessed on Dec18,
2023).
9. Josef S, et al: EULAR recommendations for the
management of rheumatoid arthritis with
synthetic and biological disease-modifying
antirheumatic drugs: 2022 update. Ann Rheum Dis.
2023 Jan;82(1):3-18.
10. Liana F, Joan M B, Bryant R E, et al: 2021
American college of rheumatology guideline for
the treatment of rheumatoid arthritis. Arthritis
Care Res. 2021 Jul;73(7):924-939.
11. Stanley Cohen, Ted R Mikuls: Alternatives to
methotrexate for the initial treatment of
rheumatoid arthritis in adults. In UpToDate
(last updated on Jan 8, 2024).
12. 周麗珍:類風濕性關節炎在治療上的新趨勢。藥學雜誌1991;8(4):99-105。
13. Van der Heijde DM, Van Riel PL, Nuver-Zwart
IH, et al: Sulphasalazine versus
hydroxychloroquine in rheumatoid arthritis:
3-year follow-up. Lancet 1990 Mar;335(8688):539.
14.
游佳玲、江俐慧、蔡慈貞等:孕哺期類風濕性關節炎治療新選擇。藥學雜誌2019;35(1):69-75。
15. Stanley Cohen, Amy Cannelia: Treatment of
rheumatoid arthritis in adults resistant to
initial conventional synthetic (nonbiologic)
DMARD therapy. In UpToDate (last updated on Apr
28, 2023)
16. Stanley Cohen, Amy Cannelia: Treatment of
rheumatoid arthritis in adults resistant to
initial biologic DMARD therapy. In UpToDate
(last updated on Feb 27, 2023).
通訊作者:陳于真/電子信箱:ycchen.phar@gmail.com

