探討葉克膜與抗感染藥物相互影響
陳文皇1、陳韋翰2、朱賢義3
1童綜合醫院藥劑部、2中山醫學大學醫學系、3童綜合醫院重症醫學部
摘要
近幾年隨著葉克膜用途及使用量的擴大,增加了許多醫療使用的複雜性,文獻指出使用葉克膜患者因為感染的死亡率為56~68%,因抗生素是嚴重感染的決定性治療方法,ECMO迴路與各個抗生素的理化特性之間存在複雜的相互作用,使達到最佳的抗生素治療具有挑戰性,而大部分是參考重症或非重症病人的使用劑量及實驗室細菌培養結果,抗生素劑量不適當造成的風險,可能使治療失敗或導致抗藥性及毒性發生。
關鍵字: 葉克膜、抗生素、藥物動力學、體外膜氧合維生系統、ECMO
壹、 前言
體外膜氧合維生系統或稱為體外循環維生系統(葉克膜;extracorporeal membrane
oxygenation, ECMO),最早在1954年由醫師John
Gibbon發明及使用於心臟手術病人1,在2009年的H1N1流感大流行時,ECMO使用於嚴重的H1N1肺炎呼吸衰竭,於2016~2017年爆發MERS-CoV感染,ECMO應用於嚴重急性呼吸道感染,近年ECMO應用在COVID-19幫助重症患者提供呼吸及循環的支持,當作治療失敗後的搶救療法
2。
使用葉克膜期間發生感染的風險很高,文獻顯示使用ECMO所有年齡組的感染率高達每1000 ECMO使用天數發生15次感染事件,相關感染的死亡率為56–68%3,抗生素是用來逆轉這些感染症,必須達臨床有效劑量及適當血中濃度,方能減少藥物毒性、治療失敗或是抗藥性的發生。由於ECMO迴路與各個藥物的理化特性之間存在複雜的相互作用,近年隨著ECMO用途及使用量的擴大,增加了許多藥物使用的複雜性,抗生素使用的選擇與劑量大部分是參考重症或非重症病人的使用劑量或實驗室細菌培養,目前許多藥物也欠缺在ECMO患者的藥物動力學數據4。
貳、對抗菌劑的影響
一、抗生素
臨床上在ECMO期間使用抗菌藥物的困難點,在於沒有易於調整劑量的參考,由Shekar等學者利用動物模型中證明,抗菌劑的親脂性和蛋白結合程度可用於預測ECMO期間的藥物動力學(pharmacokinetic,
PK),並且描述ECMO迴路和嚴重疾病對藥物PK的綜合影響,這些研究變量可進一步應用在未來。對於時間依賴型的抗生素例如β-lactams,需要瞭解使用ECMO期間藥物PK的改變,對於維持最小抑制濃度(minimum
inhibitory concentration, MIC)的影響非常重要5。
濃度依賴型性抗生素的抗菌效力與抗菌濃度尖峰成正比,例如amionoglycoside,而研究資料主要來自嬰幼兒,推論至成人需小心,例如gentamicin的分佈體積(distribution
volume, Vd)升高及藥物清除率(Clearance rate, Cl)降低,建議ECMO患者使用aminoglycoside應做臨床藥物治療監測(Therapeutic
drug monitoring, TDM)劑量調整,另外有研究顯示amikacin在有使用及未使用ECMO的重症患者兩者之間的波峰值和波谷值濃度無顯著差異6。
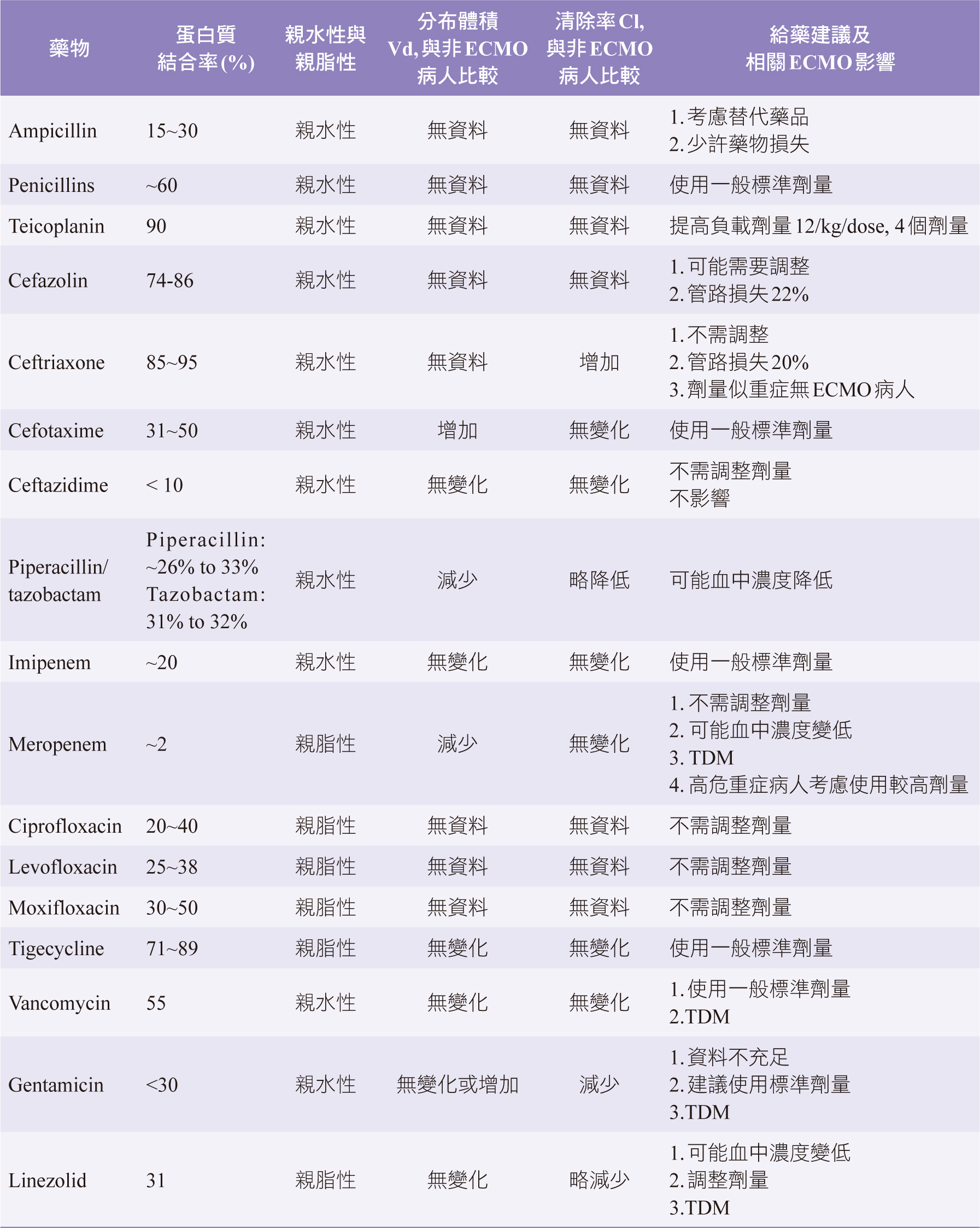
β-lactams比其他抗生素相對具親水性,但蛋白質結合率則各不相同,有研究指出ceftriaxone的蛋白質結合率超過85%
5,比其它較低蛋白質結合率的β-lactams可能有較多ECMO迴路隔離,認為在給藥間隔內,游離藥物濃度能保持高於MIC4~5倍時,可達最佳殺菌效果,也有研究認為ECMO不會顯著改變β-lactams的PK3(表一)。一項針對
ECMO 患者進行的最大規模的 TDM 研究指出,有很高比例ECMO患者中,piperacillin(48%)及linezolid(35%)血中濃度低於預定的MIC目標值,而ceftazidime
及meropenem沒有這樣的情況7。
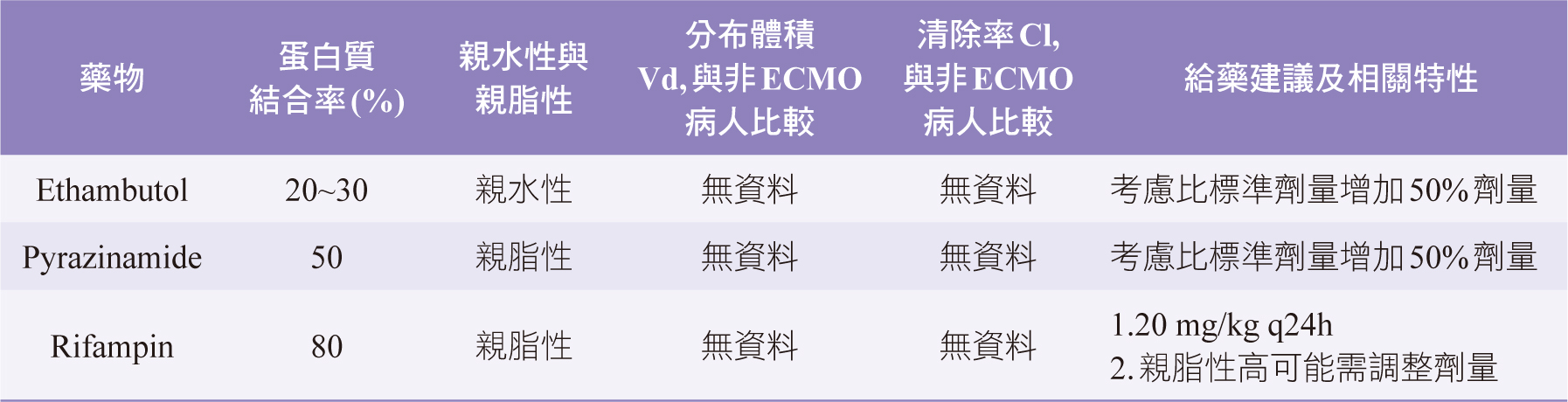
抗結核菌藥(表二)中rifampicin的親脂性可能導致藥物被隔離在ECMO迴路中,導致劑量不足,其次結核病誘導的發炎反應(tuberculosis-induced
inflammation),可能增加了CYP450媒介的代謝,並導致rifampicin濃度低於治療濃度以下6,建議從較高的劑量開始使用,並依TDM結果調整劑量3。
較不受ECMO影響的抗生素包括tigecycline、meropenem、azithromycin及fluoroquinolones類抗生素,但還有許多抗生素無研究資料或樣本數太小等,尚待未來的研究。
二、抗黴菌藥之影響
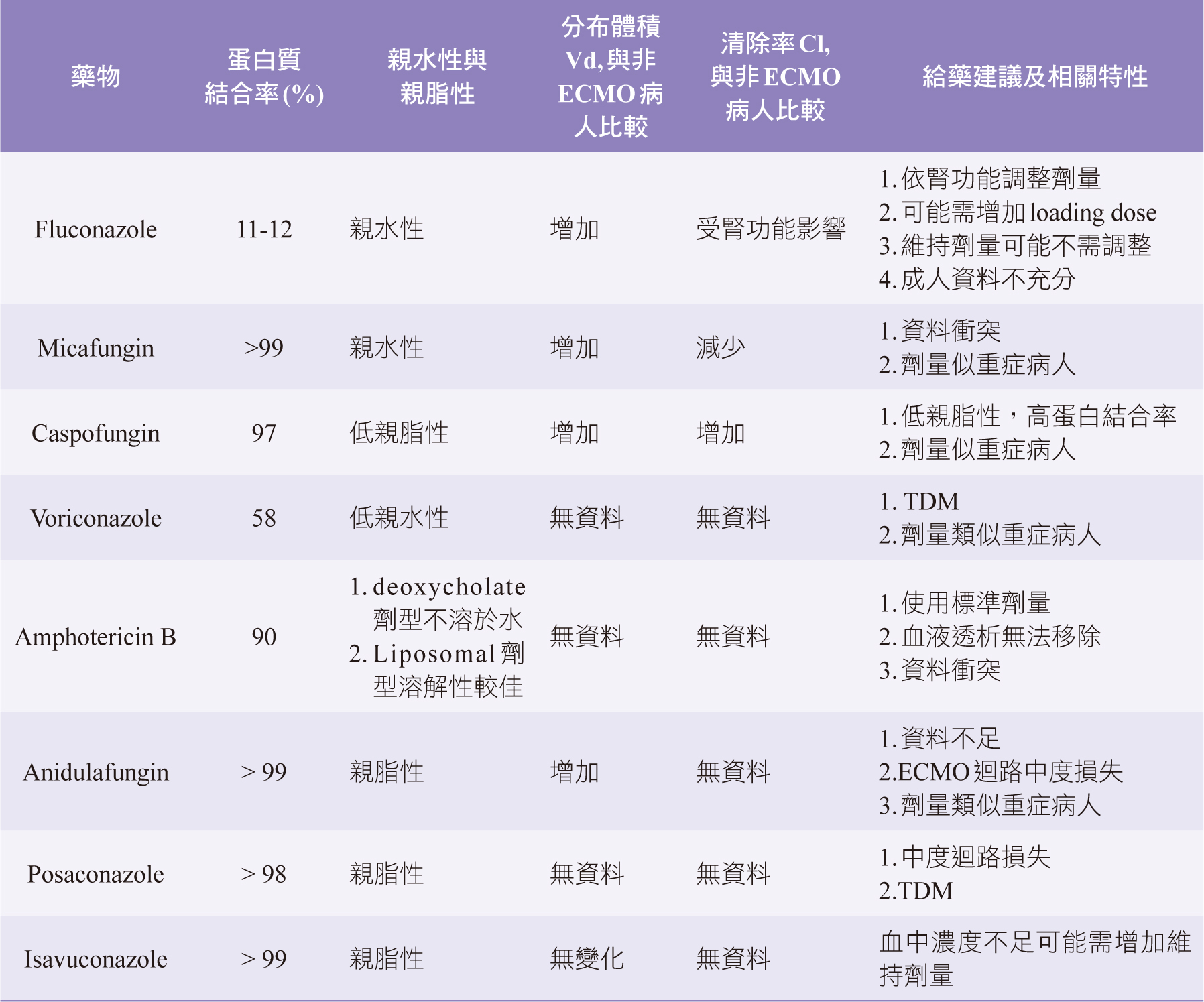
使用ECMO期間最常見的真菌感染是念珠菌,其黏附在導管上較難以根除,因此在使用ECMO期間預防及治療念珠菌變得很重要7,抗黴菌藥(表三)具有不同程度的蛋白質結合和親脂性,由於大規模藥動學研究資料有限,結果的相互矛盾4,病例報告的不一致性及樣本數目小,所以難以提出具體的劑量建議3,4,還需要更多的研究來證實。
表三 抗黴菌藥物在ECMO相關成人劑量3,4,5,11
在成年患者中,caspofungin具有較低的親脂性3,但蛋白質的結合程度很高,可能是經過迴路時產生螯合的原因,在ECMO迴路的離體模型中由於螯合作用而損失了43%
4,8,由於病例結果的不一致及樣本量很小3,因此很難針對這種藥物提出具體的劑量建議。
據研究顯示由於Voriconazole的高親脂性,可能導致71%的迴路藥物損失,若在初始劑量降低後增加劑量,由於ECMO迴路中的結合位隨著時間的流逝而飽和,最終達到毒性濃度,建議緊密TDM3,4。
參、ECMO影響藥物動力學的因素
一、ECMO的迴路因素
葉克膜迴路組成主要包括導管、氧合膜(oxygenator
membrane)及血液驅動幫浦(blood
pump)和加熱恆溫器等所構成的迴路,透過迴路發生藥物隔離(drug
sequestration)、分佈體積(distribution volume, Vd)及藥物清除率(Clearance
rate, Cl)被改變等三種方式,使藥物藥物動力學發生顯著的變化,而葉克膜迴路增加額外的體外體積,也增加了藥物可能被吸附的表面積,使形成螯合物、Cl可能被改變及大量灌注的溶液可能造成血液稀釋進而使藥物分佈、解離程度和蛋白質結合發生變化,使抗生素的劑量需求4發生改變。
藥物在ECMO迴路中與迴路結合的過程即所謂的藥物隔離(drug
sequestration)又稱為藥物萃取(drug
extraction),導致血漿藥物濃度降低,在停止給藥後,迴路可能會釋放附著在設備上的藥物,使螯合的藥物重新分配回患者體內,或者為了克服吸附現象,而給予高劑量5,可能導致藥物濃度增加而產生毒性。使用ECMO期間可能發生全身性發炎反應,使毛細血管滲漏和水腫,並引起細胞色素CYP
450媒介的代謝改變6。
二、ECMO與藥物的理化因素
研究顯示影響藥物螯合最大的兩個特性是親脂性和蛋白質結合,高度親脂性和高蛋白質結合性藥物的增加了藥物被萃取的機會,主要是由於靜電和疏水相互作用驅動的吸附所致,而吸附的程度是藥物與材料表面之間的親和力相互作用有關,現今ECMO迴路的表面塗層的應用發展,已儘量減少與血液接觸引發的發炎反應及減少吸附藥物的交互作用3,5。
三、ECMO迴路的材質
現今的ECMO迴路材質是由聚氯乙烯(polyvinyl chloride,
PVC)管、聚甲基戊烯膜(polymethylpentene membrane
oxygenator)膜氧合器所組成9,較高的藥物親脂性,更易被ECMO迴路隔離,另外,蛋白質結合的程度可能決定具有類似親脂性的藥物的隔離程度4。
Wildschut等人觀察到,與微孔-中空纖維聚丙烯膜氧合器(hollow-fibre
microporous membrane oxygenators)相比,使用有機矽膜膜氧合器(silicone
membrane oxygenators)的ECMO迴路中的fentanyl損失33%,研究顯示管路和膜氧合器材料可能是影響迴路藥物螯合程度的關鍵因素,但是因為體外研究不使用血液當灌注液,可能會高估或低估ECMO迴路中的吸附作用10,一項體外研究顯示,voriconazole在ECMO迴路中被大量隔離,約有71%的藥物損失,這是由於該藥物的高親脂性和蛋白質結合特性所致4。
四、迴路灌注
由於啟動迴路需大量外源血液及血液製品的頻繁輸注,為了維持迴路流動而進行的晶體輸液注射,可能發生血液稀釋,而對藥物PK產生影響,改變血液的pH值,影響藥物的解離和組織中的分佈3,血液稀釋對分佈僅限於血漿區室的藥物(即低Vd藥物)影響最大,廣泛分佈到組織中的藥物(即高Vd藥物)可能受到的影響較小,因為經由迴路隔離的藥物可能會被存儲在組織中的藥物所取代。
影響因素包括灌注液的類型、添加的電解質、pH值和溫度,這些因素可能會共同影響迴路中的螯合程度,這些潛在的差異,可能導致治療失敗或毒性發生5。
五、ECMO與病人疾病因素
病人的疾病狀態也是改變藥動學的潛在因素,加上與ECMO交互影響使PK更加複雜,包括腎功能不全(發生頻率30%以上)3,導致腎臟排除減少使血中藥物濃度增加,腎臟中的腎素-血管緊張素(renin-angiotension)可能上調(up-regulation)及腎小球過濾率減少,促使體液中液體的比例改變,重症患者的血清白蛋白濃度容易降低,重大疾病的病理特徵改變藥物的液體轉移和滯留、pH值和血漿蛋白結合。另外肝損傷也很常見,導致許多藥物的代謝功能下降3,5,器官功能障礙和全身性發炎反應的發展,可能導致Vd增加和清除率的降低5。
六、其它因素
肥胖患者的脂肪組織增加,為螯合親脂性藥物提供了空間,導致親脂性藥物Vd升高,而成年人體內總水分的比例較新生兒低5,血液稀釋也影響藥物PK,此外血液pH值的顯著變化也可能對蛋白質結合產生影響5,7,重症患者常併用多種藥物治療,可能改變PK導致結合蛋白的藥物的游離增加,進而改變藥物的清除率和進入組織的濃度,使ECMO相關PK資料的應用更為複雜。
肆、研究資料的限制
ECMO研究的文獻資料,大多在新生兒、嬰兒或者在離體系統中進行的結果3,與新生兒相比,成人體內總水份的比例較低,而體脂肪組織比例較高,由於藥物本身親水與親脂不同的特性,影響了藥品在身體內的分佈體積的變化5,另外,由於體外研究不使用血液或使用外源性血液,可能會高估或低估ECMO迴路中的吸附作用,近年來ECMO迴路材質及管路塗層的發展,早期的藥動學數據可能會顯著不同,並且與當前的發現相矛盾。
伍、結論
適當的抗生素治療可降低ECMO感染率及有效性,而最佳抗生素治療已顯示出與患者預後的改善相關,因為許多因素會同時影響抗生素PK,唯有透過藥物、ECMO設備及疾病因素的相互作用,對於ECMO的深入瞭解關於危重症患者PK變化,藉由這些過程瞭解PK變動性的來源,希望未來有更多ECMO給藥研究,確定適合在ECMO期間更佳抗生素使用參考,提供個人化使用策略。
Exploring the Interaction between
Extracorporeal Membrane Oxygenation and
Anti-infective Drugs
Wen-Hwang Chen1, Wei-Han Chen2,
Yin-Yee Chu3
1Department of Pharmacy, Tungs’
Taichung MetroHarbor Hospital
2School of Medicine, Chung Shan
Medical University
3Department of Critical Care, Tungs’
Taichung MetroHarbor Hospital
Abstract
In recent years, with the expansion of the use
of extracorporeal membrane oxygenation, the
complexity and challenges of the use of many
drugs especially antibiotics have also
increased. The risk of infections during the use
of extracorporeal membrane oxygenation increase
exponentially compared with critically ill
patients not using ECMO support. The mortality
rate is around 56 to 68%. Antibiotics are used
to treat these infections. However, the choice
and dosage of antibiotics are often selected and
judged based on physician's personal experience.
Because of the complex interaction between the
extracorporeal membrane oxygenation circuit and
the physical and chemical properties of each
antibiotics, it is necessary to use an effective
dose that achieves the expected clinical effect
but also limits the toxicity of the given drug.
Therefore, most of them are based on the use
dosage use in critical or non-critical ill
patients and also from in vitro tests. When the
antibiotic dose is insufficient or inadequate
can lead to treatment failure and contribute to
the risk of antibiotics resistance.
參考資料:
1. Gibbon JH: Application of a mechanical heart
and lung apparatus to cardiac surgery. Minn Med
1954;37(3):171-85.
2. Ma X, Liang M, Ding M, et al: Extracorporeal
membrane oxygenation (ECMO) in critically ill
patients with Coronavirus disease 2019
(COVID-19) pneumonia and acute respiratory
distress syndrome (ARDS). Med Sci Monit. 2020
Aug 6;26:e925364.
3. Sherwin J, Heath T, Wat K: Pharmacokinetics
and dosing of anti-Infective drugs in patients
on extracorporeal membrane oxygenation: A Review
of the Current Literature. Clin Ther. 2016
Sep;38(9):1976-1994.
4. Cheng V, Abdul-Aziz MH, Roberts JA, et al:
Optimising drug dosing in patients receiving
extracorporeal membrane oxygenation. J Thorac
Dis. 2018 Mar;10(Suppl 5):S629-S641
5. Ha MA, Sieg AC: Evaluation of altered drug
pharmacokinetics in critically ill adults
receiving extracorporeal membrane oxygenation.
Pharmacotherapy 2017;37:221-35.
6. Hahn J, Choi JH, Chang MJ: Pharmacokinetic
changes of antibiotic, antiviral,
antituberculosis and antifungal agents during
extracorporeal membrane oxygenation in
critically ill adult patients. J Clin Pharm Ther.
2017 DEC;42(6):661-671.
7. Dennis Kühn, Carlos Metz, Frederik Seiler, et
al: Antibiotic therapeutic drug monitoring in
intensive care patients treated with different
modalities of extracorporeal membrane
oxygenation (ECMO) and renal replacement
therapy: a prospective, observational
single-center study. Critical Care 2020 Nov
25;24(1):664.
8. Bizzarro MJ, Conrad SA, Kaufman DA, et al:
Infections acquired during extracorporeal
membrane oxygenation in neonates, children, and
adults. Pediatr Crit Care Med. 2011;12:277-281.
9. Florian Lemaitre, Nesrine Hasni, Pascal
Leprince, et al: Propofol, midazolam, vancomycin
and cyclosporine therapeutic drug monitoring in
extracorporeal membrane oxygenation circuits
primed with whole human blood. Crit Care.
2015;19(1):40.
10. Vesa Cheng, Mohd H. Abdul-Aziz, Jason A, et
al: Overcoming barriers to optimal drug dosing
during ECMO in critically ill adult patients.
Expert Opinion on Drug Metabolism & Toxicology.
2019 Fev;15(2):103-112.
11. Haifa Lyster, Kiran Shekar, Kevin Watt, et
al: Antifungal dosing in critically ill patients
on extracorporeal membrane oxygenation. Clin
Pharmacokinet. 2023; 62(7):931-942.
12. Wi J, Noh H, Min KL, et al: Population
pharmacokinetics and dose optimization of
teicoplanin during venoarterial extracorporeal
membrane oxygenation. Antimicrob Agents
Chemother, 2017;61(9):e01015-17
通訊作者:陳文皇/電子信箱:t2619@ms3.sltung.com.tw