第二型糖尿病新藥Tirzepatide的簡介
蕭鈞百1、吳俊男2、李建瑩2,3、吳雅惠2
1大里仁愛醫院藥劑科、2中山醫學大學附設醫院藥劑科、3中山醫學大學藥理學科
摘要
糖尿病是一種常見的慢性代謝疾病,引起大小血管病變及心血管死亡率增加有關。因此,第二型糖尿病(type
2 diabetes mellitus,
T2DM)患者良好的血糖控制及心血管危險因子管理,可以減少晚期糖尿病併發症,包括改變生活方式和藥物治療。過去幾年間,治療T2DM的新型藥物包括:鈉-葡萄糖共同轉運蛋白2抑制劑、雙基胜肽酶-4型抑制劑、類升糖素胜肽-1受體作用劑。其中GLP-1受體作用劑(liraglutide,
dulaglutide, semaglutide)是新一代的降血糖藥物,不但可有效控制血糖、減少體重,亦有顯著地減少主要心臟血管事件的發生,因此成為糖尿病治療的新趨勢。Tirzepatide屬於雙重腸泌素(twincretin)的藥物,可同時作用在葡萄糖依賴性促胰島素肽(GIP)受體和類升糖素胜肽-1(GLP-1)受體。臨床試驗證實,具有有效的降血糖和減肥作用。FDA於2022年5月核准,適應症是用於改善第二型糖尿病病人的血糖,作為飲食和運動的輔助療法。本文將簡介tirzepatide的作用機轉、適應症、臨床療效及安全性。
關鍵字: GLP-1、Glucagon-like peptide-1 receptor
agonist、腸泌素、Incretin hormone、Tirzepatide
壹、前言
糖尿病是種常見的慢性代謝疾病。在臺灣第二型糖尿病(type 2 diabetes
mellitus,
T2DM)流行病學,根據2019年以全民健保資料庫為基礎所報告的「台灣糖尿病年鑑」統計,T2DM人數隨著時間的增加而增加,20-79歲成年人口的盛行率由2000年時的4.31%,增加至2014年的6.38%1。根據
2021年國人十大死因統計顯示,糖尿病為國人排行第5大死因(死亡人數
11,450人;死亡率每十萬人口48.8人)2。對於T2DM患者來說,良好的血糖控制及心血管危險因子管理,可以減少晚期糖尿病併發症,建議以醣化血紅素(hemoglobin
A1c, HbA1c)低於7.0 %(需個別化考量)、血壓(< 140/90
mmHg)、低密度脂蛋白膽固醇(< 100 mg/dL)及身體質量指數(BMI, 18.5-24
kg/m2)作為治療目標1。
在「2022第2型糖尿病臨床照護指引」中提到,T2DM病人高血糖的治療通常包括第一線用藥metformin及生活型態調整(健康的飲食營養和運動)。當HbA1c高於個別化目標值1.5%以上,建議併用二種以上不同機轉的抗糖尿病藥使用1。這時可選擇的藥品包括磺醯脲類(sulfonylurea,
SU)、α-葡萄糖苷酶抑制劑(α-glucosidase inhibitors,
AGI)、thiazolidinedione (TZD)、鈉-葡萄糖共同轉運蛋白2抑制劑(sodium-glucose
cotransporter 2 inhibitors,
SGLT-2i)、雙基胜肽酶-4型抑制劑(dipeptidyl peptidase-4
inhibitor, DPP-4
inhibitor)、類升糖素胜肽-1受體作用劑(glucagon-like peptide-1
receptor agonist, GLP-1
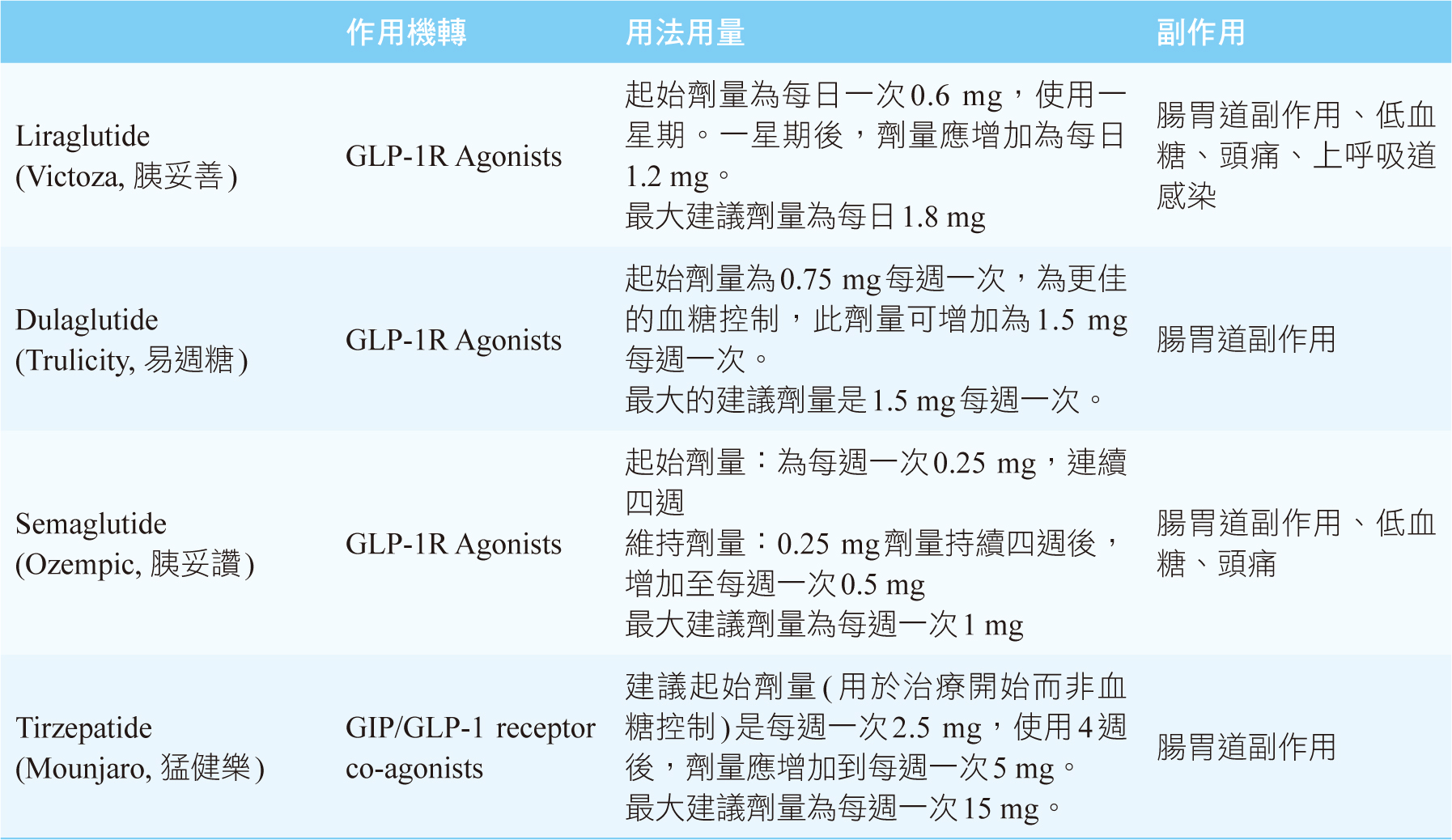
RAs)或是胰島素。GLP-1受體作用劑是新一代的降血糖藥物,目前市場上有liraglutide
(Victoza, 胰妥善)、dulaglutide (Trulicity, 易週糖)和semaglutide
(Ozempic,
胰妥讚)(表一)。不但可有效控制血糖、減少體重,亦有顯著地減少主要心臟血管事件的發生,因此成為糖尿病治療的新趨勢。
Tirzepatide屬於新型雙重腸泌素(twincretin)的藥物,可同時作用在葡萄糖依賴性促胰島素肽(glucose-dependent
insulinotropic polypeptide, GIP)受體和類升糖素胜肽-1 (glucagon-like
peptide-1, GLP-1)受體。同時活化GIP和GLP-1兩種受體後,會刺激胰臟β細胞分泌胰島素以及減少胰臟α細胞分泌昇糖素(glucagon)。除此之外,GLP-1還會延緩胃排空、刺激下視丘飽食中樞(增加飽食感)進而抑制食慾(降低體重),而GIP則在營養和能量代謝上發揮重要的作用,兩種受體同時被活化後可能具有協同作用(synergistic
effect),從而對於血糖控制和體重減輕有加成的效果3。接下來將綜合論述tirzepatide的臨床治療資訊。
貳、Tirzepatide (Mounjaro)
一、適應症和用法劑量
美國食品藥物管理局於2022年5月13日核准,適應症是用於改善第二型糖尿病病人的血糖3,4,作為飲食和運動之外的輔助療法。每週皮下注射一次,可在一天中的任何時間注射,不論空腹或飯後。
建議起始劑量(用於治療開始而非血糖控制)是每週一次2.5
mg,使用4週後,劑量應增加到每週一次5
mg。如果需要更加嚴格的血糖控制,應在當前劑量使用至少4週後,每次調升2.5
mg。最大建議劑量為每週一次15 mg3,4。錯過劑量時,應在4天(96小時)內盡快施打,如果超過4天,則應跳過,依原定時程繼續注射下一劑。如果有必要時,可以改變每週注射的日期,但兩次給藥之間的時間至少相隔3天(超過72小時)。選定新的注射日之後,應持續每週注射一次。劑型為預填充型注射器,有不同的劑量包裝供選擇使用。以原包裝冷藏(2-8℃)儲存,室溫(≤30℃)下最多僅可放置21天。
二、藥理機轉和藥物動力學
Tirzepatide是GIP/GLP-1受體作用劑。是第一個可同時活化GIP和GLP-1兩種受體的藥物。Tirzepatide可增強第一和第二階段的胰島素分泌(glucose-dependent
insulin secretion),並降低昇糖素水平,延緩胃排空而抑制食慾4。可降低T2DM患者的空腹和餐後葡萄糖濃度,減少食物攝入並減輕體重。
Tirzepatide是39個氨基酸修飾的線性肽(linear
peptide),具有C20脂肪二酸部分,透過醯化反應(acylation
reaction)能夠結合白蛋白並延長半衰期。Tirzepatide與給藥劑量呈現出線性的藥物動力學特性(dose-proportionally),在腹部、大腿或上臂給藥時,其藥物暴露量相似,給藥部位不影響藥物動力學特性。以皮下給予的生體可用率(bioavailability)約為80%,達到最高血中濃度時間(Tmax)約為8-72小時。每週給藥一次,給藥四次後達到穩定的血中濃度(steady-state
plasma concentrations)。在T2DM患者中,穩定分布體積(volume of
distribution, Vd)約10.3 L3。血漿蛋白質結合率約99%。平均排除半衰期(elimination
half-life)約為5天4。其代謝物主要通過尿液和糞便排泄。根據體外研究,tirzepatide較不具有抑制或誘導CYP450酵素的作用3,因此較不易發生交互作用。
參、臨床研究結果
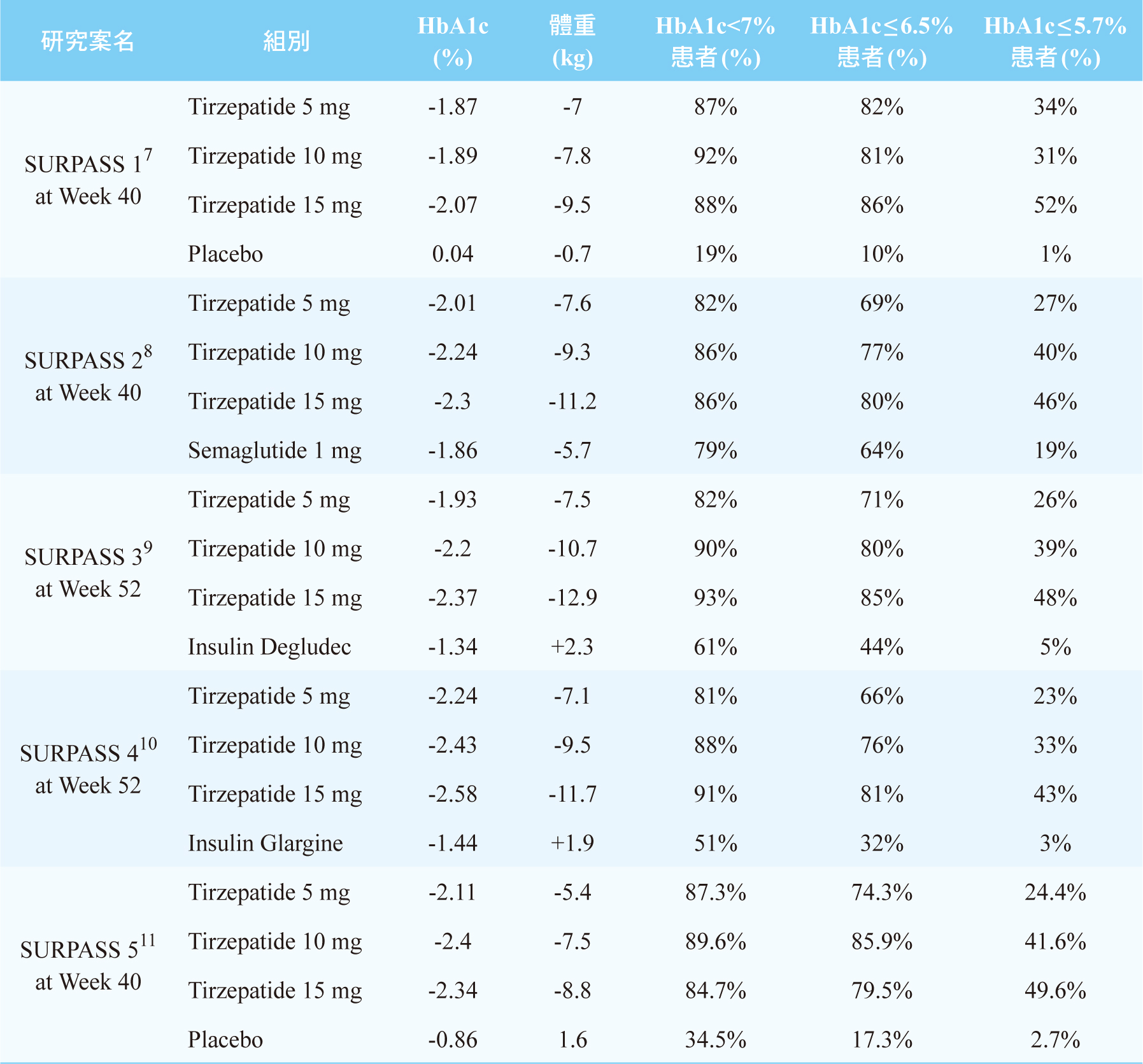
FDA依據Tirzepatide綜合性第三期臨床試驗數據(SURPASS1-5)的結果(表二)5-11,核准它的新藥申請(new
drug application, NDA),適用於除了飲食和運動外,改善糖尿病病人的血糖控制輔助療法。下面將詳述這些臨床試驗的結果。
表二 Tirzepatide的臨床試驗結果
一、SURPASS-1試驗
採隨機、雙盲、多中心、安慰劑對照試驗5,6,7,收納478位僅透過飲食和運動控制不佳的第二型糖尿病成年患者,以1:1:1:1的比例隨機分組,每週皮下注射tirzepatide
5 mg (n=121)、10 mg(n=121)、15 mg (n=121)或安慰劑
(n=115),為期40週。平均年齡54.1歲,52%為男性,T2DM病史平均為4.7年,平均體重85.9
kg,BMI平均為31.9 kg/m2,HbA1c基準值為7.94%。
結果顯示7,tirzepatide組的HbA1c平均值與基準值比較分別為-1.87%、-1.89%和-2.07%,安慰劑組則增加0.04%。用藥組的HbA1c比安慰劑組多下降1.91%
(CI:-2.18至-1.63)、1.93% (CI:-2.21至-1.65)與2.11%
(CI:-2.39至-1.83),P值均<0.001。與安慰劑相比,tirzepatide組有更多比例的參與者達到HbA1c低於7.0%
(87-92% vs 19%)、低於6.5% (81-86% vs 10%)和低於5.7%
(31-52% vs
1%)。Tirzepatide組體重與基線相比的變化為-7.0、-7.8和-9.5
kg,而安慰劑組-0.7 kg
(P<0.001)。Tirzepatide對體重的影響是漸進的和劑量依賴性的。在安全性方面,任何不良事件(any
adverse events)的比例和嚴重不良事件(serious adverse
events)的數量在各組之間相似。最常見的不良事件是輕度至中度的胃腸道事件,包括噁心(12-18%
vs 6%)、腹瀉(12-14% vs 8%)和嘔吐(2-6% vs 2%)。此試驗設計單獨tirzepatide與安慰劑相比較,在HbA1c控制和體重方面顯示優良效果,而沒有增加低血糖的風險。
二、SURPASS-2試驗
這是個頭對頭(Head to Head)試驗,直接比較tirzepatide和semaglutide兩種藥品的治療效果5,6,8。採隨機、開放性(tirzepatide劑量分組為雙盲試驗)、跨國多中心,主動控制semaglutide對照試驗。收納1879位僅使用metformin穩定劑量治療但血糖控制不佳(HbA1c:7-10.5%)的第二型糖尿病成年患者,以1:1:1:1比例隨機分組,每週皮下注射tirzepatide
5 mg (n=470)、10 mg (n=469)、15 mg (n=470)或semaglutide
(n=469),為期40週。平均年齡56.6歲,47%為男性,T2DM病史平均為8.6年,平均體重93.7
kg,BMI平均為34.2 kg/m2,HbA1c基準值為8.28%。
結果顯示8,tirzepatide組的HbA1c平均值與基準值比較分別為-2.01%、-2.24%和-2.3%,而semaglutide組則是-1.86%。與semaglutide相比,tirzepatide三組的HbA1c分別多下降0.15%
(CI:-0.28至-0.03)、0.39% (CI:-0.51至-0.26)與0.45%
(CI:-0.57至-0.32),有統計上明顯差異(P<0.001)。所有劑量的tirzepatide組優於semaglutide組。與semaglutide相比,tirzepatide組有更多比例的參與者達到HbA1c低於7.0%
(82-86% vs 79%)、低於6.5% (69-80% vs 64%)和低於5.7%
(27-46% vs
19%)。Tirzepatide組體重與基線相比的變化為-7.6、-9.3和-11.2 kg,而semaglutide組-5.7
kg。Tirzepatide組體重減輕幅度大於semaglutide組,分別為1.9
(CI:-2.8至-1.0)、3.6 (CI:-4.5至-2.7)和5.5 kg
(CI:-6.4至-4.6),都有統計上明顯差異(P<0.001)。在安全性方面,所有組別的受試者最常見的副作用有噁心(17.4-22.1%
vs 17.9%)、腹瀉(13.2-16.4% vs 11.5%)和嘔吐(5.7-9.8% vs
8.3%)。此試驗中顯示,所有劑量的tirzepatide在降低T2DM的HbA1c效果不劣於(noninferior)且優於semaglutide
1mg。在減重方面,也優於semaglutide 1mg。而副作用並沒有更高。
三、SURPASS-3試驗
採隨機、開放性、跨國多中心,比較tirzepatide和insulin degludec的療效和安全性5,6,9。收納1437位使用metformin穩定劑量治療(使用或不使用SGLT-2抑制劑)後,血糖仍未得到有效控制的第二型糖尿病成年患者。以1:1:1:1比例隨機分組,每週皮下注射tirzepatide
5 mg (n=358)、10 mg (n=360)、15 mg
(n=359)或每天睡前一次皮下注射insulin degludec
(n=460),為期52週。平均年齡57.4歲,56%為男性,T2DM病史平均為8.4年,平均體重94.3
kg,BMI平均為33.5 kg/m2,HbA1c基準值為8.17%,有32%同時使用SGLT-2抑制劑。
結果顯示9,tirzepatide組的HbA1c平均值與基準值比較分別為-1.93%、
-2.2%和-2.37%,而insulin degludec組則是-1.34%。與insulin
degludec相比,tirzepatide三組的HbA1c分別多下降0.59%
(CI:-0.73至-0.45)、0.86% (CI:-1.00至-0.72)與1.04%
(CI:-1.17至-0.9),P值均<0.001。與insulin degludec相比,tirzepatide組有更多比例的參與者達到HbA1c低於7.0%
(82-93% vs 61%)、低於6.5% (71-85% vs 44%)和低於5.7%
(26-48% vs
5%)。Tirzepatide組體重與基線相比的變化為-7.5、-10.7和-12.9kg,而insulin
degludec組則增加2.3kg。Tirzepatide組分別多下降9.8
(CI:-10.8至-8.8)、13 (CI: -14至-11.9)和15.2 kg
(CI:-16.2至-14.2),P<0.001。最常見的不良事件是輕度至中度胃腸道事件,包括噁心(12-24%
vs 2%)、腹瀉(15-17% vs 4%)、食慾下降(6-12% vs
1%)和嘔吐(6-10% vs 1%)。由試驗結果得知,所有劑量的tirzepatide優於長效胰島素degludec。在第52週時,可降低更多HbA1c和體重,出現低血糖風險更低。
四、SURPASS-4試驗
此試驗為SURPASS項目中收案人數最多,時間最長的研究。採隨機、開放性、跨國多中心,比較tirzepatide和insulin
glargine (100 U/mL)之療效和安全性5,6,10。收納1995位患有第二型糖尿病且是心血管疾病(CV)高風險的成年患者,使用1-3種口服降糖藥(metformin,
sulfonylurea,
SGLT-2i)後血糖仍控制不佳。以1:1:1:3比例隨機分組,每週皮下注射tirzepatide
5 mg (n=329)、10 mg (n=328)、15 mg
(n=338)或每天睡前一次皮下注射insulin glargine
(n=1000),為期52週。平均年齡63.6歲,62%為男性,T2DM病史平均為10.5年,平均體重90.3
kg,BMI平均為32.6 kg/m2,HbA1c基準值分別為8.52%。
結果顯示10,tirzepatide組的HbA1c平均值與基準值比較分別為-2.24、-2.43%和-2.58%,而insulin
glargine組則是-1.44%。與insulin glargine相比,tirzepatide組的HbA1c分別多下降0.8%
(CI:-0.92至-0.68)、0.99% (CI:-1.11至-0.87)與1.14%
(CI:-1.26至-1.02),P值均<0.001。與insulin glargine相比,tirzepatide三組有更多比例的參與者達到HbA1c低於7.0%
(81-91% vs 51%)、低於6.5%(66-81% vs
32%)和低於5.7%(23-43% vs
3%)。Tirzepatide組體重與基線相比的變化為-7.1、-9.5和-11.7
kg,而insulin glargine組則增加1.9kg。Tirzepatide組分別多下降9.0
(CI:-9.8至-8.3)、11.4 (CI: -12.1至-10.6)和13.5 kg
(CI:-14.3至-12.8),P<0.001。最常見的不良事件為噁心(12-23% vs
2%)、腹瀉(13-22% vs 4%)、食慾下降(9-11% vs <1%)和嘔吐(5-9%
vs
2%)。大多是輕度至中度,並且會隨著時間的推移而減少。由試驗結果得知,T2DM且是CV高風險的患者中,與胰島素glargine相比,在第52週時,所有劑量的tirzepatide,可降低更多HbA1c和體重,且不會增加心血管疾病風險。
五、SURPASS-5試驗
採隨機、雙盲、多中心、安慰劑對照研究5,6,11,收納475位接受insulin
glargine (100 U/mL)控制不佳的第二型糖尿病成年患者(使用或不使用metformin),以1:1:1:1的比例隨機分組,每週皮下注射tirzepatide
5 mg (n=116)、10 mg (n=119)、15 mg
(n=120)或安慰劑(n=120),為期40週。評估insulin glargine合併tirzepatide治療的有效性和安全性。平均年齡60.6歲,56%為男性,T2DM病史平均為13.3年,BMI平均為33.4
kg/m2,HbA1c基準值為8.31%。有82.9%同時使用metformin。
結果顯示11,tirzepatide組的HbA1c平均值與基準值比較分別為-2.11%、-2.4%和-2.34%,而安慰劑組-0.86%。與安慰劑組相比,使用tirzepatide組分別多下降1.24%
(CI:-1.48至-1.01),1.53% (CI:-1.77至-1.3)與1.47%
(CI:-1.71至-1.23),P值均<0.001。與安慰劑相比,tirzepatide組有更多比例的參與者達到HbA1c低於7.0%
(84.7-89.6% vs 34.5%)、低於6.5% (74.3-85.9 vs
17.3%)和低於5.7% (24.4-49.6% vs
2.7%)。與安慰劑相比較,全部P<0.001。Tirzepatide組體重與基線相比的變化為-5.4、-7.5和-8.8
kg,而安慰劑組則增加1.6 kg ( P<0.001)。與安慰劑相比較,差異為多下降7.1
(CI:-8.7至-5.4)、9.1 (CI:-10.7至-7.5)和10.5 kg
(CI:-12.1至-8.8),P<0.001。Tirzepatide組最常見的不良事件是輕度至中度的胃腸道事件,包括腹瀉(12%-21%
vs 10%)、噁心(13%-18% vs 2.5%)、噁心(7-13% vs
2.5%)和食慾下降(7-14% vs 1.7%)。對於使用胰島素glargine後仍然無法達標者,再加上tirzepatide後,與安慰劑相比,在第40週時可明顯降低更多HbA1c和體重。
肆、安全性和副作用
Tirzepatide最常見的不良反應(發生率≥5%)是腹痛(5-6%)、便秘(6-7%)、食慾下降(5-11%)、腹瀉(12-17%)、消化不良(5-8%)、噁心(12-18%)、嘔吐(5-9%)等3,4。大多數胃腸道不良反應發生率會隨tirzepatide劑量增加而增加,並隨使用時間而減少發生3。預計懷孕或懷孕期間的婦女,應避免使用。哺乳方面,目前不確定tirzepatide是否會進入母乳,所以哺乳期間不建議使用。肝腎功能不全的患者無需調整劑量。Tirzepatide會延遲胃排空,且可能影響其他口服併用藥物的吸收率。當病人口服需胃腸道快速吸收的藥品時,應特別謹慎。
因會提高甲狀腺C細胞腫瘤(thyroid C-cell tumours)的發生率,所以FDA要求在仿單中加註警語。Tirzepatide禁止用於本身或家族有甲狀腺髓質癌(MTC)病史的病人,或罹患第二型多發性內分泌腫瘤症候群(Multiple
Endocrine Neoplasia syndrome type 2, MEN 2)的病人3,4。
伍、總結
隨著社會生活型態、飲食習慣的改變及人口的老化,全世界糖尿病人口盛行率有持續攀升的趨勢。良好的血糖控制不只可以降低大小血管疾病的發生,還可以增加病人的生活品質。Tirzepatide是第一個獲得FDA核准的GIP/GLP-1雙重受體作用劑。臨床數據(SURPASS
1-5)證實具有顯著的有效性和安全性。Ttirzepatide 15 mg可降低HbA1c
2.07-2.58%,體重可降低9.5-12.9
kg,常見的不良反應多為腸胃道方面,但不會增加低血糖風險。評估Tirzepatide長期對心血管的療效和安全性臨床試驗正在進行中(SURPASS-CVOT),期待會有正面的結果。針對肥胖症(obesity)的臨床試驗正在進行中(SURMOUNT
1-4)。對於肥胖或體重過重的第二型糖尿病病人而言,Tirzepatide可提供了另一個治療的新選擇。
The Introduction of Tirzepatide
for Type 2 Diabetes Mellitus
Chun-Pai Hsiao1, Chun-Nan Wu2
, Chien-Ying Lee2,3, Ya-Hui Wu2
1Department of Pharmacy, Jen-Ai
Hospital, Taichung
2Department of Pharmacy, Chung-Shan
Medical University Hospital
3Department of Pharmacology,
Chung-Shan Medical University
Abstract
Type 2 diabetes mellitus (T2DM) is a chronic
progressive disease associated with
microvascular and macrovascular complications
and increased cardiovascular mortality.
Management of T2DM, therefore, includes dietary
intervention and lifestyle modification to
promote weight loss along with pharmacotherapy
to combat hyperglycaemia and optimise metabolic
parameters such as blood pressure and lipids.
The last 15 years or so have seen new classes of
diabetes medications available for management of
T2DM: glucagon-like peptide 1 (GLP-1) receptor
agonists, dipeptidyl peptidase 4 (DPP4)
inhibitors and sodium–glucose co-transporter 2
(SGLT2) inhibitors. Glucagon-like peptide 1
receptor agonists(liraglutide, dulaglutide,
semaglutide) are effective and promote weight
loss. Tirzepatide is a single molecule that
combines dual agonism of glucose-dependent
insulinotropic polypeptide (GIP) and glucagon-like
peptide-1 receptors. In May 2022, tirzepatide
received its first approval in the USA to
improve glycaemic control in adults with T2DM,
as an adjunct to diet and exercise. The
objective of this article is to review the
efficacy and safety of tirzepatide.
參考資料:
1. 2022第2型糖尿病臨床照護指引。臺北:社團法人中華民國糖尿病衛教學會。
2. 衛生福利部:110年國人死因統計結果。臺北:衛生福利部統計處。
3. Syed YY: Tirzepatide First Approval. Drugs.
Drugs. 2022;82(11):1213-20.
4. IBM Micromedex® DRUGDEX®(electronic version).
5. Tall Bull S, Nuffer W, Trujillo JM:
Tirzepatide: A novel, first-in-class, dual GIP/GLP-1
receptor agonist. J Diabetes Complications.
2022;36(12):108332. Epub 2022 Oct 5.
6. Forzano I, Varzideh F, Avvisato R, et al:
Tirzepatide: A Systematic Update. Int J Mol Sci.
2022;23(23):14631.
7. Rosenstock J, Wysham C, Frías JP, et al:
Efficacy and safety of a novel dual GIP and
GLP-1 receptor agonist tirzepatide in patients
with type 2 diabetes (SURPASS-1): a
double-blind, randomised, phase 3 trial. Lancet.
2021;398(10295):143-55.
8. Frias JP, Davies MJ, Rosenstock J, et al:
Tirzepatide versus semaglutide once weekly in
patients with type 2 diabetes. N Engl J Med.
2021;385(6):503-15.
9. Ludvik B, Giorgino F, Jodar E, et al:
Once-weekly tirzepatide versus once-daily
insulin degludec as add-on to metformin with or
without SGLT2 inhibitors in patients with type 2
diabetes (SURPASS-3): a randomised, open-label,
parallel-group, phase 3 trial. Lancet.
2021;398(10300):583-98.
10. Del Prato S, Kahn SE, Pavo I, et al:
Tirzepatide versus insulin glargine in type 2
diabetes and increased cardiovascular risk
(SURPASS-4): a randomised, open-label,
parallel-group, multicentre, phase 3 trial.
Lancet. 2021;398(10313):1811-24.
11. Dahl D, Onishi Y, Norwood P, et al: Effect
of subcutaneous tirzepatide vs placebo added to
titrated insulin glargine on glycemic control in
patients with type 2 diabetes: the SURPASS-5
randomized clinical trial. JAMA.
2022;327(6):534-45.
通訊作者:吳雅惠/電子信箱:cshd117@csh.org.tw