奈米醫藥之非臨床考量
張泰華
麥迪森醫藥股份有限公司桃園廠生產事業處
摘要
藥物的最重要考量為「品質、安全、有效」,不管是大分子/小分子藥物或醫療器材,使用到奈米技術的情形將更普遍,奈米尺度是無法用目視檢測的,應該更加注意因此而產生的相關利益與風險。於研發階段即應掌握充足之安全性及有效性資訊,本文主要聚焦於奈米醫藥之非臨床考量議題(品質、安全、風險),後續產品生命週期階段(產品上市和臨床使用),若有發現任何與研發階段相關的風險因子,即應重新檢視與評估產品的「品質、安全、有效」是否仍在可接受的範圍。
關鍵字: 奈米
壹、前言
奈米醫學是將奈米技術應用於醫藥領域的學科1,主要應用於藥品輸送系統、顯影劑、含藥醫療器材、體外診斷試劑等2,有助於開發新的疾病治療與診斷方法,期望能達到使診斷更精確與治療更有效的目的。
在2010年9月2-3日,歐洲藥品管理局(EMA)舉辦了第一屆奈米醫藥國際科學研討會,與會專家討論奈米技術應用到藥品所產生的利益與挑戰3。人造奈米系統的優勢,如精準給藥、複合的診斷/治療功能,當時的實際產品已包括微脂體劑型(liposomal
formulations)、奈米微粒(nanoparticles)與聚合物/鍵結物(polymers/conjugates)等。
本文引用從財團法人醫藥品查驗中心官網,藥物知識專區-國際醫藥法規新知項目中輸入關鍵字「奈米」所查到之相關文章4,綜合討論與奈米醫藥相關之非臨床考量議題。
貳、奈米醫藥的安全考量3
奈米學能深入到分子操控的範疇,在奈米尺度創造出新的奈米材料,目的是提供直接標靶治療,因此僅需要非常低的劑量(理論上)。若給予非常低的劑量,安全性的議題將會相對變少,通常能藉由加上標誌分子,確認藥物釋放後能正確的到達標靶位置。
血腦障壁是藥物傳輸到大腦的主要門控機制,但奈米藥物可以小到能穿過血腦障壁的正常輸送機制,直接進入到大腦。某些療法的安全性正是因為基於有完整的血腦障壁能防止藥物進入大腦,若此門控機制失效將會顯著地影響患者、製藥業與相關的製造廠商。
奈米微粒大小的變化,因其獨特的物化性質,改變了此藥物成分原有之特性,應重新徹底思考其藥動藥效(PK/PD)。目前通常將奈米尺度定義為1-100
nm,但不全然代表當藥物分子大於100
nm時,其物化性質就會與奈米尺度不同,具體應視個案而定。重點在於評估是否因為大小改變而造成其物化性質與生物效能的不同,不應過於聚焦在尺寸的大小。舉例來說,因溶解度問題失敗的藥物,若將藥物大小奈米化後以標靶形式傳輸進體內,也許可以顯示出其治療效果。
參、奈米醫藥的品質與風險3,5
在體外模仿體內系統是艱鉅的任務,因受到諸多因素影響,例如給藥途徑、材料劑型、冠冕效應,及與細胞表面的交互作用等,都需要在進行安全性評估時加以考慮。評估奈米醫藥的安全性應從品質與風險二個層面來考量,分述如下:
一、品質層面
(一) 製程再現性
製造過程中的管制措施,應確保能從起始原料、後續之生合成過程、關鍵之中間產物、最終之萃取/純化步驟,均能確保再現性,重複地產出品質一致的產品。
(二) 殘留溶劑或製程殘留物
建議以ICH Q8(R2)-Pharmaceutical development及ICH
Q11-Development and manufacture of drug
substances (chemical entities and
biotechnological/biological
entities)所強調的品質源於設計(quality by
design)概念來進行中間產物和/或在製程中的適當品質管制措施。
(三) 微粒的不良分散性(dispersibility)&聚集作用(aggregation)
奈米醫藥並非均相的(homogenous)群體,而是利用專門的系統設計出帶有複雜性可變的奈米尺度。
(四) 描述組成(description and composition)
應依照預期的使用功能來定義產品規格內的關鍵品質屬性,並正確定義其相關物化特性參數。這是必要的,但並不容易。以「嵌段共聚物微胞(block
copolymer micelles)來傳輸藥物」為例,應描述:
1. 其化學結構 。
2. 若嵌段共聚物與其攜帶的藥物成分有形成化學鍵結,該化學鍵結的化學性質與安定性。
3. 雜質的組成與分布。
4.
最終產品之品質特性,包括微胞的粒徑大小、形狀、Zeta電位、其他表面特性(標靶配體)、聚集數、奈米結構的濃度依賴性、載藥量、化學結構、藥物成分的物理狀態、黏度、嵌段共聚物微胞在血液或相關溶媒的體外安定性及降解,以及體外試驗中藥物成分從微胞釋出的情形。
5. 最終產品在活體內作用之相關屬性
滲透壓、微胞表面的藥物成分比例、藥物成分的釋出部位及釋出率,及嵌段共聚物的降解率及降解部位。
(五) 安定性(Stability)
試驗設計應參考ICH Q1A(R2)-Stability testing of new drug
substances and drug
products或欲上市國家之相關法規,若產品含生物製劑,應參考ICH
Q5C-Stability testing of
biotechnological/biological
products。安定性試驗結果應清楚證明產品之安定性條件。
二、風險層面
(一) 表面活性增加
奈米材料/奈米微粒的尺寸,是否導致對細胞和器官的反應性增加,進而誘發了毒性反應?傳統的劑量是以質量濃度呈現,但對奈米微粒來說,其毒理學評價因存在劑量度量不確定性,採用「表面積或微粒數目」可能更適合。
(二) 潛在的交互作用
1.生物系統中的各種分子和蛋白質將附著到奈米微粒,這樣的包覆(coatings)可能增加細胞對奈米微粒的識別,但其生物效應為何?當然特定的包覆應用也提供了標靶至特定細胞的可行性。
2.奈米微粒在體內的生物環境中,與許多的蛋白質和脂質連結,形成了某種動態的冠冕(corona),許多早期的生物反應也被定義為冠冕相關生物分子(associated
corona biomolecules)。冠冕對於奈米微粒的生物相容性和毒性具有重要影響,因為可能決定了其在生物體內的分佈、代謝、清除和生物效應。
3.小於100 nm的奈米微粒能進入細胞,不到40 nm的奈米微粒能進入細胞核,小於35
nm的奈米微粒則能通過血腦障壁。奈米微粒以主動程序被帶入細胞中,並利用明確的途徑運送到特定的次細胞位置。在細胞層級,許多奈米微粒進入溶酶體途徑,可堆積達幾個小時無法清除,其累積和清除可能取決於蛋白質冠冕的性質。
(三) 免疫毒性之評估
奈米結構的種類繁多,其大小、形狀和表面特性均具有可變的特性,因此免疫毒性的異質性(heterogeneity)似乎是奈米醫藥的特點,也是對免疫安全性評估的關鍵門檻。免疫毒性之評估,應特別考量對於四類免疫毒性的影響,即免疫抑制(immuno-suppression)、免疫刺激(immuno-stimulation)/免疫激活(immuno-activation)、過敏(hypersensitivity)和自體免疫(auto-immunity)。奈米材料/奈米微粒已被觀察到會產生免疫作用,但是也有矛盾或相反的結果被報導。因此,對於大多數奈米醫藥尚無法做出或缺乏明確的免疫效果結論。建議於研發階段應先執行短期重覆劑量毒性試驗,試驗中應納入影響免疫功能的重要指標,並記錄相關的測試結果,藉以說明此奈米醫藥之免疫毒性或對免疫功能之影響。
肆、奈米藥品查驗登記之臨床前藥動考量2
由於奈米醫藥的快速發展及應用,除了法規上特別的要求外,產品研發過程中之試驗設計考量應以提供充足之安全性及有效性資訊為原則,只要能充分闡明其合理性與支持研發理念,試驗設計之形式不拘。
醫藥品查驗中心針對奈米載體及奈米化藥品,就國內新藥查驗登記應執行的藥動學試驗項目提出之建議方案,整理如下(表一)。
除了上述的建議資訊外,若有需要針對特定藥動參數進行評估(如:生殖毒性、基因毒性、致癌潛能),可參考國際醫藥法規協和會(International
Council for Harmonisation of Technical
Requirements for Pharmaceuticals for Human Use,
ICH)所制定的相關指南。
伍、脂質奈米粒包覆 mRNA 疫苗類型產品6
2020年1月初,中國首次分享新型冠狀病毒(SARS-CoV-2)的全基因組序列,Moderna與BioNTech兩家藥廠,即投入COVID-19
mRNA疫苗的設計與量產開發計畫,採取以脂質奈米粒(lipid nanoparticles,
LNPs)包覆mRNA核酸的疫苗產品。目前mRNA疫苗的生產製備,普遍使用體外轉錄(in-vitro
transcription, IVT)技術平台,採取無細胞之酵素製程進行;相較於其他傳統類別疫苗(例如:病毒載體、不活化/去活化病毒、與基因重組製造蛋白質次單元),mRNA疫苗的優勢在於其製程不包括繁瑣的病毒種批與疫苗生產細胞受質株(庫)、關鍵起始物之製備,且實際量產時不須進行長時間的生產細胞擴增培養流程。
如同其他的生物製劑,mRNA疫苗產品開發過程相當複雜,從臨床前開發階段的小規模試製、到大規模臨床試驗需求的生產,均會面臨製程中使用的原物料、生產設備與流程步驟,甚至是產品配方調整等各種類型的變更,變更結果是否對產品品質一致性造成影響,須要全面審慎評估;針對品質管控分析方法的合適性評估尤其重要,若品質分析方法不合適,將影響檢測結果之信賴程度,危及產品的品質與安全。
LNP包覆mRNA疫苗產品的技術應用相對較新穎,由世界衛生組織(World Health
Organization, WHO)率先發表LNP包覆mRNA疫苗產品的法規考量;由於有開發之迫切醫療需求,美國藥典(US
Pharmacopeia, USP)發布一套適用於mRNA疫苗原料藥及其成品放行規格檢驗之品質分析方法標準。參考USP公告之第二版草案內容,整理mRNA疫苗原料藥及其成品建議之放行規格,如下(表二)。
表二 USP-mRNA疫苗原料藥及其成品放行規格(第二版草案)
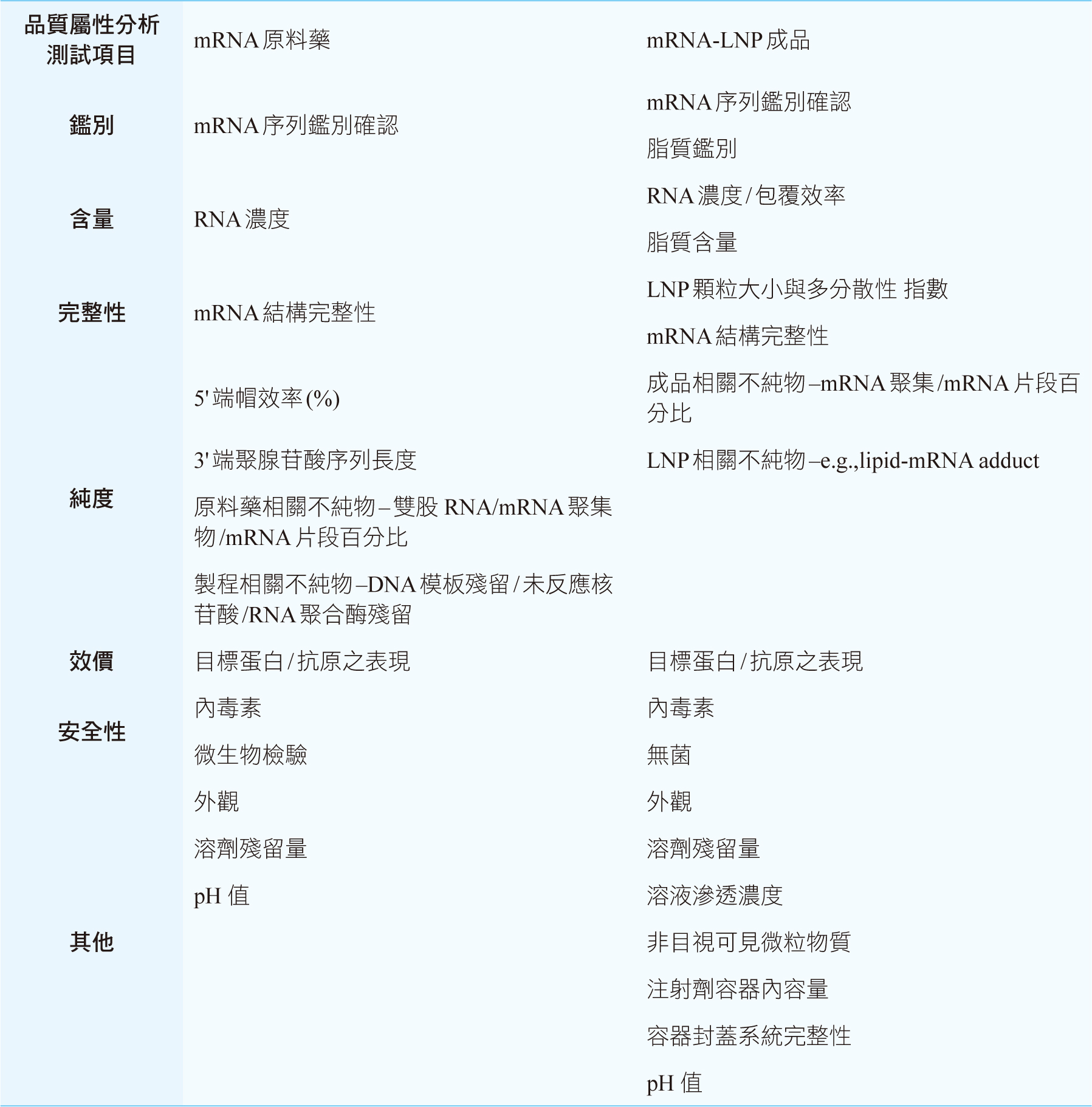
一、USP建議在原料藥規格檢驗階段
(一)須分析並規範mRNA聚集不純物(mRNA
aggregation)之限量,以確保製程的一致性並提高mRNA的生物活性、穩定性與安全性。
(二)使用cell-based
assay作為效價測試、並分析mRNA原料藥,是否可被順利轉譯成目標蛋白/抗原。
二、LNP包覆mRNA疫苗成品規格部分
(一)再次建議分析mRNA聚集不純物限量的必要性。
(二)因有研究指出,LNP產品所使用的可離子化陽離子脂質(ionizable cationic
lipid)結構中,具有三級胺構造,在經過氧化與水解反應降解之後,可生成具有反應性的lipid不純物,能與mRNA核苷酸上的鹼基反應形成lipid-mRNA
adducts;為確保mRNA疫苗產品不會因lipid-mRNA
adduct及相關不純物而影響活性,建議增加lipid-mRNA adduct的含量管制。
陸、結論
本文從奈米醫藥之安全性開始說明,建議應從品質與風險二個層面來評估,並以奈米載體&奈米化藥品建議應執行的藥動學試驗項目、USP-mRNA疫苗原料藥及其成品放行規格(第二版草案)做相關說明,期待讓大家有最基礎的認識。
奈米醫藥應以利益/風險方法為基礎來管理,在研發、上市和使用奈米醫藥的過程中,應隨時考慮其益處與風險,因為兩者是相互關聯的,應建立一個系統化的方法來識別、評估、管理和監控,這是動態的過程,需要持續評估和調整。且應依據產品特性,開發一套適合的品質分析方法和管制標準,以確保產品上市後的品質能持續保持穩定,也確保於臨床使用上的安全性和有效性能得到最大化的實現。
Non-clinical Considerations of
Nanomedicine
Tai-Hua Chang
Production Department, Aseptic Innovative
Medicine Co., Ltd.
Abstract
The most important considerations for drugs are
"quality, safety, and efficacy". Whether it is
large molecule/small molecule drugs or medical
devices, the use of nanotechnology will become
more common. Since the nanoscale cannot be
detected visually, greater attention should be
paid to the associated benefits and risks
arising from it. During the research and
development stage, sufficient safety and
efficacy information should be obtained. This
article mainly focuses on non-clinical
considerations of nanomedicine (quality, safety,
risks). In subsequent stages of the product
lifecycle (product launch and clinical use), if
any risk factors related to the research and
development stage are identified, the product
should be re-examined and evaluated to see
whether the product's <quality, safety, and
efficacy> are still within the acceptable range.
參考資料:
1. 奈米醫學(2022年12月7日):維基百科。 2024年3月1日,取自:https://zh.wikipedia.org/zh-tw/纳米医学
2. 徐立峰、王藝琳:奈米藥品查驗登記之臨床前藥動考量。當代醫藥法規月刊RegMed 2017
Vol.79。
3. 汪徽五:歐盟奈米醫藥國際科學研討會紀實—奈米醫藥的非臨床議題。當代醫藥法規月刊RegMed
2011 Vol.8:5-11。
4. 國際醫藥法規新知 [Internet]. 財團法人醫藥品查驗中心.
2024年3月1日,取自:https://www.cde.org.tw/knowledge/?pid=1&years=&id=&keys=%E5%A5%88%E7%B1%B3&x=0&y=0
5.
汪徽五、周家瑋:以奈米微胞做為傳輸化療藥物的設計考量及國際醫藥法規管理新進展。當代醫藥法規月刊RegMed
2015 Vol.53。
6.
謝東儒、黃豐淳:脂質奈米粒包覆mRNA疫苗類型產品—於CMC放行規格檢測項目與適合的分析方法考量。當代醫藥法規月刊RegMed
2023 Vol.154。
通訊作者:張泰華/電子信箱:cowboy0215@gmail.com


