肺動脈高壓新治療-Sotatercept
蔡玉娟、楊媛婷
彰化基督教醫院藥學部
摘要
肺動脈高壓(pulmonary arterial hypertension, PAH)是一種嚴重的肺血管病變,導致肺血管阻力增加和右心室功能障礙。骨形態發生蛋白受體II型(bone
morphogenetic protein receptor type II, BMPR-II)基因突變是遺傳性和特發性PAH的一個重要病理因素,使血管中BMPR-II路徑的抗增殖訊號減少,及活化素受體IIA型(activin
receptor type IIA, ActRIIA)的促增殖訊號增強,BMP路徑功能失調促進血管平滑肌細胞增生,與肺血管異常重塑有關。Sotatercept是一ActRIIA-Fc融合蛋白,與活化素和生長分化因子結合,重新平衡生長促進和生長抑制訊號,恢復PAH相關的肺動脈和右心室傷害。美國食品藥物管理局於2024年核准sotatercept用於治療成人PAH,此新作用機制藥物為PAH病人提供更多治療選擇,以改善心肺功能,減緩或逆轉心血管重塑,並降低臨床惡化事件風險。
關鍵字:pulmonary arterial
hypertension、BMPR-II、activin、sotatercept、reverse
remodeling
壹、 前言
肺高壓(pulmonary hypertension,
PH)是一種罕見且嚴重的漸進性肺血管病變,定義為經右心導管檢查的平均肺動脈壓>20
mmHg。世界衛生組織(World Health Organization,
WHO)依病因將肺高壓分成5類(表一),肺動脈高壓(pulmonary arterial
hypertension, PAH)屬於肺高壓第一類(Group 1 PH)1,2。伴隨有末梢肺血管阻力升高(pulmonary
vascular resistance, PVR) > 2 Wood units (WU)
且肺動脈楔壓 (pulmonary arterial wedge pressure, PAWP)
≤15 mmHg1,3。其特徵為肺部末梢小動脈異常重塑(remodeling),造成動脈管腔逐漸狹窄,增加肺血管阻力、肺動脈壓和右心室後負荷,最終導致右心室功能障礙和右心衰竭3,4。
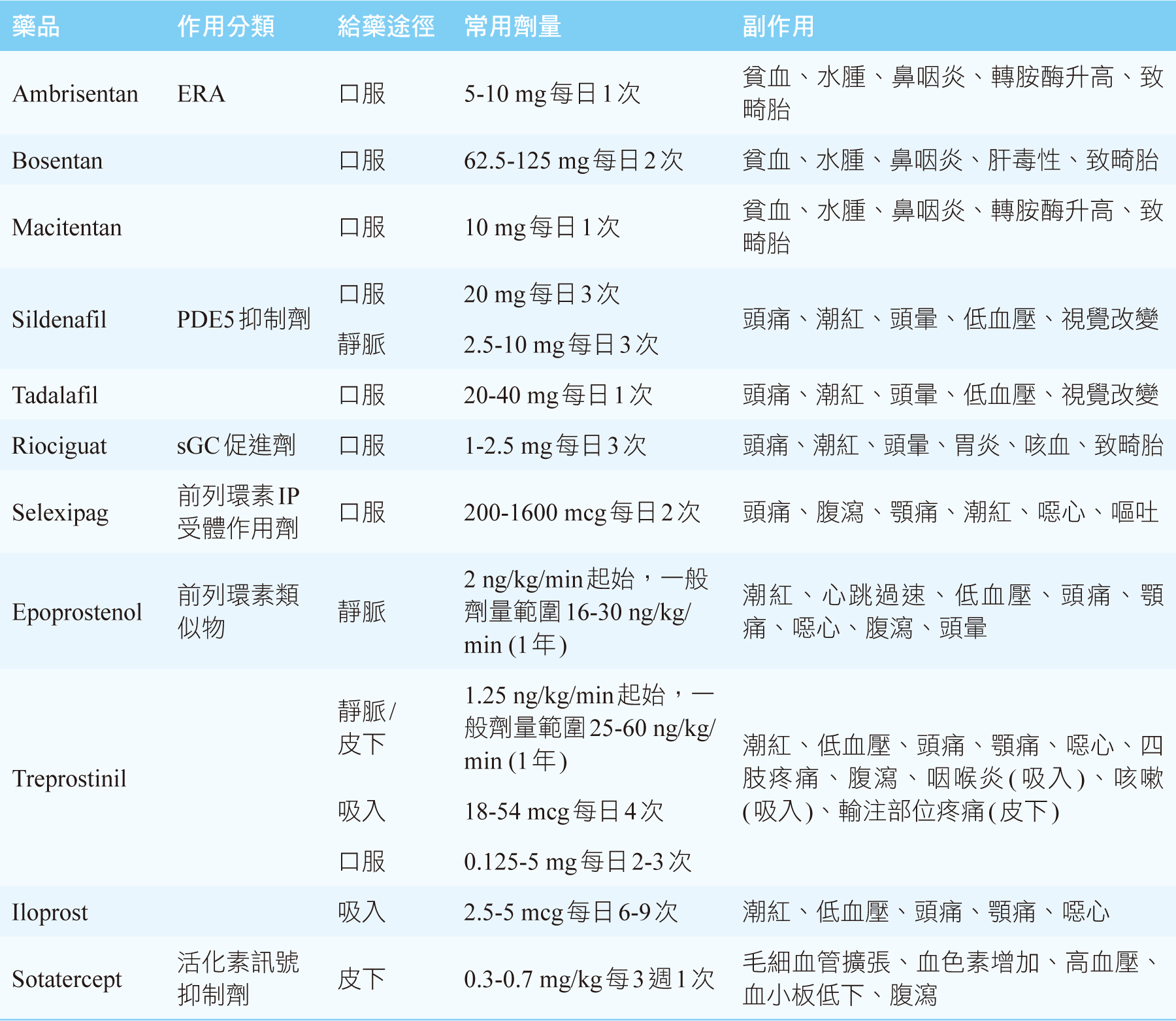
目前核准PAH藥品以舒張肺血管為作用標的,包含內皮素受體拮抗劑(endothelin
receptor antagonist, ERA,如ambrisentan、bosentan、macitentan)、第五型磷酸二酯酶抑制劑(phosphodiesterase
5 inhibitor, PDE5抑制劑,如sildenafil、tadalafil)、可溶性鳥苷酸環化酶促進劑(soluble
guanylate cyclase stimulator, sGC促進劑,如riociguat)和前列環素路徑作用劑(selexipag、epoprostenol、treprostinil、iloprost)(表二)1,2,5。2022年歐洲心臟學會/歐洲呼吸學會肺高壓治療指引建議在沒有合併心肺共病的特發性/遺傳性/藥物或結締組織相關PAH,依風險狀態聯合2種至3種藥物作為起始治療1;有心肺合併症已接受PDE5抑制劑或ERA單一用藥,處於中度或高度死亡風險者,可再附加PAH用藥1。然而許多病人在以調節肺血管張力為標的用藥下,疾病風險狀態並未降低或未達治療目標,長期預後仍不佳,罹病後5-7年的估計存活率僅約50%,因此需要針對PAH根本原因以恢復血管恆定的新一代標的藥品6。Sotatercept是第一個抑制活化素訊號的新型融合蛋白,於2024年美國食品藥物管理局核准適用於PAH7,本文將綜述sotatercept的臨床治療資訊。
貳、 肺動脈高壓之病理生理學
WHO依病因將PAH分成6種亞型,而第2種遺傳性PAH與基因異常有關1,8,編碼骨形態發生蛋白受體II型(bone
morphogenetic protein receptor type II, BMPR-II)基因的異型合子發生突變,是導致PAH最常見遺傳原因,佔超過70%家族性和20%特發性PAH4,9。BMPR-II是BMP路徑的絲氨酸(serine)/息寧胺酸(threonine)激酶跨膜受體,屬於轉化生長因子β(transforming
growth factor β, TGF-β)超家族成員,BMPR-II路徑維持肺動脈內皮功能完整性,為成人組織恆定所必需4,
10。
基因突變造成肺血管平滑肌和內皮細胞中的BMPR-II-Smad
1/5/8路徑下調(downregulation)或活性降低,引發促增殖和抗增殖功能之間的不平衡。此不平衡導致活化素配體(activin
ligands),如活化素A、生長分化因子(growth differentiation
factors, GDF)8和GDF11的過度活化,進而促進活化素受體IIA型 (activin
receptor type IIA, ActRIIA)-Smad (small mothers
against decapentaplegic) 2/3路徑,被活化的Smad
2/3促使天然BMP拮抗劑(gremlin 1和noggin)基因表現,進一步減少BMP-Smad
1/5/8訊息傳遞,此過程持續循環的累積結果為抗增殖訊號減少,致使平衡轉向促增殖活化素-Smad
2/3訊號,導致肺血管重塑8,10。
參、 Sotatercept(Winrevair)
一、作用機轉
Sotatercept是由人類ActRIIA胞外結構區融合至IgG1的Fc片段所組成的ActRIIA-Fc融合蛋白(fusion
protein),為一活化素訊號抑制劑,與活化素和GDF配體結合,減少ActRIIA/Smad2/3訊號,改善促增殖(ActRIIA/Smad2/3-媒介)和抗增殖(BMPRII/Smad1/5/8-媒介)訊號間之平衡,調節血管增生及改善肺部血管重塑7,10。在肺高壓動物模式中,sotatercept抑制血管壁的細胞增殖,促進細胞凋亡,減輕發炎反應,使逆轉血管重塑和恢復血管通暢性11。
二、藥物動力學
皮下給藥後絕對生物可用率約66%,達最高藥物濃度中位數時間約為7天(2-8天),分布體積約5.3公升,半衰期約24天,清除率約0.18公升/天,經分解代謝途徑降解成小胜肽。在輕至中度腎功能不全(eGFR
30-89 mL/min)或末期腎病(eGFR <15 mL/min)且接受血液透析者並未觀察到藥物動力學臨床顯著差異,重度腎功能不全者(eGFR
15-30 mL/min)預期不影響sotatercept藥物動力學;尚無肝功能不全者的藥物動力學研究;年齡小於18歲的有效性和安全性目前亦尚未確立7。
三、臨床研究及安全性
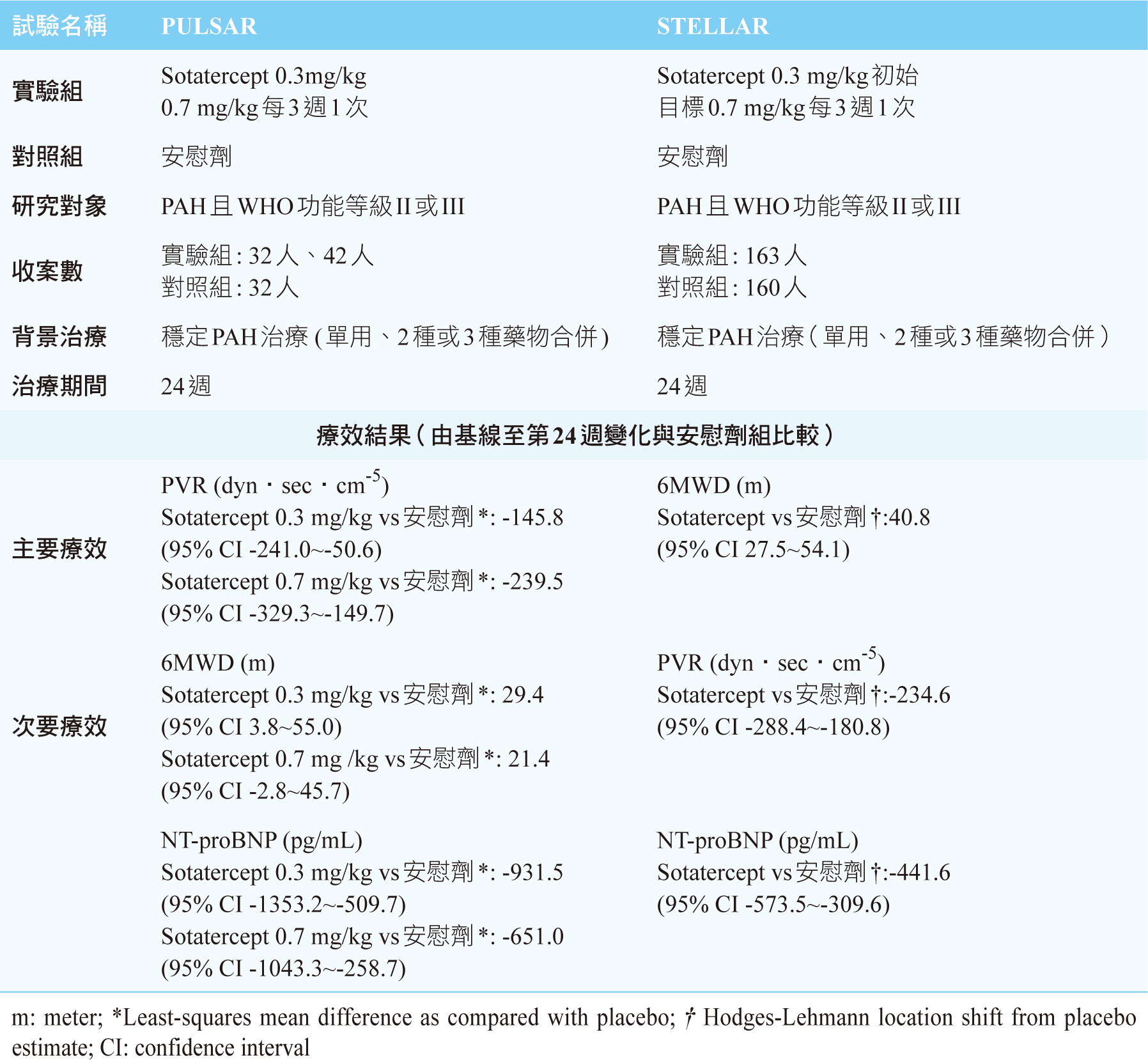
二項重要隨機、雙盲,安慰劑對照研究,分別為二期PULSAR和三期STELLAR試驗,皆納入PAH病人、其WHO功能等級第II級或第III級、年齡≥18歲,且已接受至少90天以上穩定標準療法(單用、合併2種或3種藥物,包括ERA、PDE5抑制劑、sGC促進劑、前列腺素類似物或前列腺素受體作用劑)9,11,比較病人已使用PAH標準用藥再加上每3週皮下給藥一次sotatercept與安慰劑之療效和安全性差異。完成PULSAR試驗後的開放性延伸試驗PULSAR
open-label extension,為評估長期療效6。
(一) PULSAR試驗
隨機分派至sotatercept(0.3 mg/kg (n=32)、0.7 mg/kg
(n=42))或安慰劑(n=32)。主要療效指標為基線到24週的PVR變化。結果顯示sotatercept
0.3 mg/kg和0.7 mg/kg相對於安慰劑差異(以LSMD (least-squares
mean difference) vs placebo),PVR顯著減少145.8 dyn‧sec‧cm-5
(p=0.003)與239.5 dyn‧sec‧cm-5
(p<0.001),0.7
mg組比基線減少34%。次要療效結果,sotatercept比安慰劑的六分鐘行走距離(6-minute
walk distance, 6MWD)增加29.4公尺(0.3 mg組)與21.4公尺(0.7
mg組)、N端B型利鈉肽前驅物(N-terminal pro-B-type
natriuretic peptide, NT-proBNP)減少931.5 pg/mL
(0.3 mg組) 與651.0 pg/mL (0.7
mg組)(表三)、改善WHO功能等級(0.3 mg組31%、0.7
mg組17%、安慰劑12%),及較少臨床惡化事件(1% vs
6%)。但三尖瓣環平面收縮期偏移(systolic excursion of the
tricuspid annular plane)的平均變化在sotatercept並沒有顯著差異10。
在安全性方面,sotatercept組有較高比例發生頭痛、腹瀉、頭暈、血小板低下及血色素數值增加不良事件;血小板低下(0.3
mg組6%、0.7 mg組12%、安慰劑0%)和血色素值增加(0.3 mg組3%、0.7
mg組17%、安慰劑0%)10。
(二) PULSAR open-label extension試驗
PULSAR隨機試驗106人,97人進入開放延伸試驗(open-label
extension),將原先安慰劑組以1:1隨機再分配至sotatercept 0.3
mg/kg或0.7 mg/kg(安慰劑-交叉組),而原先sotatercept組維持最後劑量(持續-sotatercept組)。主要療效評估基線至第18-24個月的PVR變化,結果發現,安慰劑-交叉組和持續sotatercept組比基線值的PVR顯著降低(-223
dyn‧s‧cm-5, p<0.0001與213 dyn‧s‧cm-5,
p<0.0001);持續sotatercept從結束24週PULSAR試驗到18-24個月仍能維持PVR效果(-3±159
dyn‧s‧cm-5, p=0.8745)6。32位(30.8%)通報嚴重治療引起不良事件;10位(9.6%)因不良事件而中止研究6。
(三) STELLAR試驗
以1:1比例隨機分配,每3週一次皮下注射sotatercept初始劑量0.3
mg/kg,第2次訪視調整至0.7 mg/kg (n=163)或安慰劑
(n=160),主要療效指標為基線到第24週的6MWD變化。結果顯示sotatercept增加6MWD
34.4公尺(95% CI 33.0~35.5),而安慰劑增加1.0公尺(95% CI
-0.3~3.5); 以Hodges-Lehmann估計sotatercept和安慰劑組從基線到第24週之差異,sotatercept組的6MWD顯著增加40.8公尺(p<0.001)。在次要療效指標,sotatercept比安慰劑顯著降低PVR
(-234.6 dyn‧sec‧cm-5, p<0.001)、減少NT-proBNP
(-441.6 pg/mL, p<0.001)(表三)、改善WHO功能等級(29.4% vs
13.8%, p<0.001)、降低死亡或非致命性臨床惡化事件時間的風險(hazard
ratio=0.16, 95% CI 0.08~0.35,
p<0.001)、改善多組成指標比例(複合6MWD、NT-proBNP和WHO功能等級)(38.9%
vs 10.1%, p<0.001)、較多French低風險比率(39.5% vs 18.2%,
p<0.001)、降低PAH-SYMPACT (Pulmonary Arterial
Hypertension-Symptoms and Impact)身體影響面向分數(-0.26,
p<0.05)及降低PAH-SYMPACT心肺症狀面向分數(-0.13, p<0.05);但PAH-SYMPACT認知/情感影響未達顯著差異11。
在安全性方面,sotatercept比安慰劑有較高的毛細血管擴張(10.4% vs
3.1%)、血色素值升高(平均增加1.3 g/dL; 5.5% vs
0%)、血小板低下(6.1% vs 2.5%)、出血事件(21.5% vs
12.5%,多數為非嚴重的鼻出血和牙齦出血)、頭暈(10.4% vs
1.9%)、頭痛(20.2% vs 15.0%)、腹瀉(12.3% vs
7.5%)、疲倦(10.4% vs 7.5%)和血壓升高(3.7% vs 0.6%)等不良事件11。
四、臨床使用
Sotatercept核准用於治療成人PAH以增加運動能力,改善WHO功能等級並降低臨床惡化事件風險。每3週皮下給藥1次,建議起始劑量為0.3
mg/kg,依血小板和血色素數值,調升至目標劑量0.7 mg/kg7。常見副作用包含血小板減少、血色素值升高、鼻出血、毛細血管擴張、頭痛、頭暈和高血壓等2,7。引起血小板減少的機制尚不明確,而因促紅血球細胞生成作用使血色素升高則與劑量相關3,因此給藥前,及給藥後至少前5次劑量於每次給藥前應監測血紅素和血小板數值,若數值不穩定需延長監測時間,此後應定期檢查,以調整劑量或停藥7。嚴重出血及血小板數低於50,000/mm3因可能增加出血風險時,切勿給藥。用藥期間若血色素值較前一次增加>2.0
g/dL且高於正常值上限、血色素較基線增加>4.0 g/dL、血色素增加高出正常值上限2.0
g/dL以上,或血小板數低於50,000/mm3則需暫停給藥,延遲治療至少3週;當再重新開始給藥前需再次檢查血紅素和血小板數值。對於已持續延遲治療超過9週者,由低劑量0.3
mg/kg重新開始,並在可接受的血色素和血小板數值後調升至0.7 mg/kg7。
根據動物試驗結果,可能對胎兒造成傷害,懷孕分級為May cause fetal
harm。懷孕期間避免使用,用藥期間及直到停藥後至少4個月應採取有效避孕方式;亦可能會影響生育能力;在哺乳方面,不確定是否進入母乳,用藥期間和停藥後4個月內不建議哺乳;目前仍缺乏肝功能不全者資料,使用前需謹慎考量7。
肆、結語
Sotatercept是第一個非以血管擴張作用的PAH新藥,抑制活化素訊息,重新平衡BMP路徑,減少不適當促增殖,以逆轉肺血管重塑為治療目標。從臨床試驗結果顯示sotatercept與現有標準療法互相配合,同時聯合多種不同作用途徑的積極治療策略更能有效降低肺血管阻力、改善活動能力、減緩症狀、延長臨床惡化時間,且耐受性良好。給藥前及用藥期間應定期血液監測血小板和血色素值,並注意出血副作用以確保用藥安全。Sotatercept提供PAH病人的重要治療新進展,期待未來有更多證據應用於症狀較嚴重、未曾接受過治療、其他類型肺高壓及兒童與青少年族群。
New Treatment for Pulmonary
Arterial Hypertension—Sotatercept
Yu-Chuan Tsai, Yuan-Ting Yang
Department of Pharmacy, Changhua Christian
Hospital
Abstract
Pulmonary arterial hypertension (PAH) is a
severe pulmonary vasculopathy that results in
increased pulmonary vascular resistance and
right ventricular dysfunction. Mutations in bone
morphogenetic protein receptor type 2 (BMPR-II)
gene are a major pathogenesis of PAH underlying
heritable and idiopathic PAH leading to reduce
anti-proliferative signaling of BMPR-II pathway
and enhance pro-proliferative signaling of
activin receptor type IIA (ActRIIA) pathway in
vascular wall. Dysfunction BMP pathway that
promotes vascular smooth muscle cell
proliferation is associated with abnormal
pulmonary vascular remodeling. Sotatercept is an
ActRIIA-Fc fusion protein that binds to activins
and growth differentiation factors, therefor,
rebalancing the growth-promoting and
growth-inhibiting signals, reverting PAH-related
damage in the pulmonary artery and right
ventricular. In 2024, the US Food and Drug
Administration approved sotatercept for the
treatment of adults with PAH. This novel
medication offers more therapeutic options in
patients with PAH to improve cardiopulmonary
function, slow or reverse cardiovascular
remodeling, and reduce the risk of clinical
worsening events.
參考資料:
1. Humbert M, Kovacs G, Hoeper MM, et al: 2022
ESC/ERS Guidelines for the diagnosis and
treatment of pulmonary hypertension. European
Heart Journal 2022;43:3618-731.
2. Torbic H, Tonelli AR: Sotatercept for
pulmonary arterial hypertension in the inpatient
setting. Journal of Cardiovascular Pharmacology
and Therapeutics 2024;29:1-9.
3. Miguel IMd, Cruz-Utrilla A, Oliver E, et al:
Novel molecular mechanisms involved in the
medical treatment of pulmonary arterial
hypertension. Int. J. Mol. Sci. 2023;24:4147.
4. Orriols M, Gomez-Puerto MC, Dijke PT: BMP
type II receptor as a therapeutic target in
pulmonary arterial hypertension. Cell. Mol. Life
Sci. 2017;74:2979-95.
5. Hopkins W, Rubin LJ: Treatment of pulmonary
arterial hypertension (group 1) in adults:
Pulmonary hypertension-specific therapy.
Available at https://www.uptodate.com. Accessed
2024 Apr. 10.
6. Humbert M, McLaughlin V, Gibbs JSR, et al:
Sotatercept for the treatment of pulmonary
arterial hypertension: PULSAR open-label
extension. Eur Respir J 2023;61:2201347.
7. Sotatercept: Summary of product
characteristics. [Revised 2024 Mar; cited 2024
Mar 27]. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/761363s000lbl.pdf.
8. Hye T, Hossain MR, Saha D, et al: Emerging
biologics for the treatment of pulmonary
arterial hypertension. Journal of drug targeting
2023;31:1-15.
9. Condon DF, Agarwal S, Chakraborty A, et al:
Novel mechanisms targeted by drug trials in
pulmonary arterial hypertension. Chest
2022;161:1060-72.
10. Humbert M, McLaughlin V, Gibbs JSR, et al:
Sotatercept for the treatment of pulmonary
arterial hypertension. N Engl J Med
2021;384:1204-15.
11. Hoeper MM, Badesch DB, Ghofrani HA, et al:
Phase 3 trial of sotatercept for treatment of
pulmonary arterial hypertension. N Engl J Med
2023;388:1478-90.
通訊作者:蔡玉娟/電子信箱:89905@cch.org.tw