試驗用藥服務管理實務
陳昶名1、王秀艷2、張秀珍2、楊偉伶2
1臺北市立萬芳醫院藥劑部、2臺北市立萬芳醫院臨床試驗研究中心
摘要
臨床試驗藥局提供之試驗用藥服務或研究用藥服務(investigational drug
service,
IDS)目的在協助臨床試驗以安全、有效、和有效率的方式執行。醫院建置一座功能完備的臨床試驗藥局有助於試驗藥師進行試驗藥品管理,並吸引藥廠或生技公司選擇該醫院作為執行臨床試驗的機構。試驗藥師必須於試驗執行期間確保試驗藥局功能運作良好,並隨時監控環境溫度變化,避免試驗藥品因不適當儲存環境使其品質受影響。試驗藥師同時必須維護受試者的用藥安全,建立一套標準作業流程降低試驗用藥錯誤的發生。本文旨在介紹如何建置臨床試驗藥局,並提供試驗藥品管理實務經驗。
關鍵字: 試驗用藥服務、臨床試驗藥局、試驗藥師、試驗藥品、臨床試驗
壹、前言
臨床試驗藥局提供之研究用藥服務或試驗用藥服務(investigational drug
service, IDS)目的在協助臨床試驗以安全、有效、和有效率的方式執行1。提供試驗藥品一個安全且適宜的環境,避免試驗藥品因不當的儲存環境使其品質受影響,進而影響臨床試驗的結果。臨床試驗專責藥師的重要性在於:試驗藥師須確保試驗藥品的品質和療效,以保障受試者的安全與權益、試驗藥師須維持臨床試驗藥局的運作,協助推動臨床試驗執行進度2。基於試驗藥品種類的多樣性、試驗藥品送達臨床試驗藥局時間的不確定性、主持人收案的突發性,建議臨床試驗藥局至少配置兩名專責藥師,相互支援以維持臨床試驗藥局良好的功能。由於臨床試驗須耗費大量的資金、人力、與時間方能完成,故試驗藥品管理方式應以藥品管理的最高標準看待。
貳、臨床試驗藥局建置
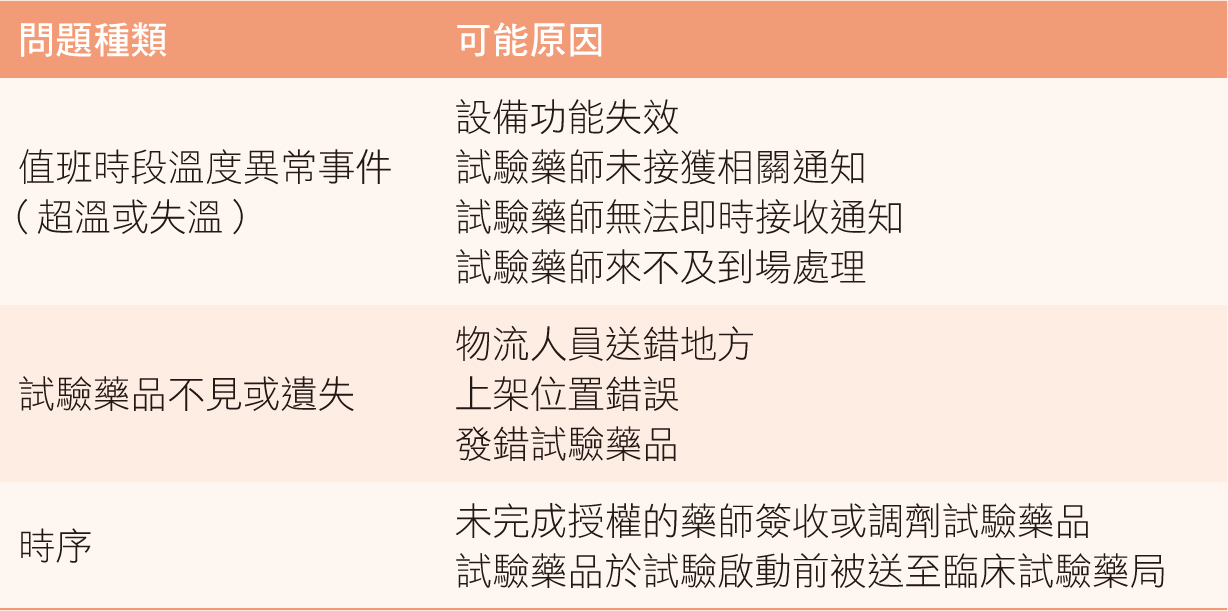
為克服試驗藥品管理常見問題(表一),完善的臨床試驗藥局必須具有六項基本設備或功能:可設定進出權限的門禁裝置、可獨立上鎖的藥品儲存空間、可維持恆定溫度的空調和冷藏櫃、可設定記錄時間的連續溫濕度記錄器、可偵測溫度異常並發出警報的溫度警報系統、以及各項功能的備援方案3,
4。
表一 試驗藥品管理常見問題
一、可設定進出權限的門禁裝置
為維護試驗藥品的安全與遵守臨床試驗的保密義務,除緊急狀況外,臨床試驗藥局平時應僅限臨床試驗專責藥師進出。臨床試驗藥局應設置一張備用門禁卡,放置於藥局24小時值班空間,如急診藥局等,並張貼緊急應變辦法。若值班時段臨床試驗藥局發生溫度異常情形,值班藥師須立即通報試驗藥師並依試驗藥師指示先行協助進行緊急應變辦法,等待試驗藥師到場接手處理。
二、可獨立上鎖的藥品儲存空間
由於多數試驗藥品包裝外觀無明顯顏色或特殊標示,僅以一張臨床試驗專用標籤標示試驗編號、藥品名稱、批號、藥品編號、效期等,故臨床試驗每案應有各自獨立可上鎖的儲存空間,避免發生試驗藥品上架錯誤、混淆、取錯藥品等調劑錯誤情事發生。同時應針對未使用、使用、與過期試驗藥品做好分類與標示,並隨時做好文件記錄。試驗藥品管理相關文件應歸入藥局資料夾(pharmacy
binder)內,建議與試驗藥品放置同一儲存空間。
三、可維持恆定溫度的空調和冷藏櫃
試驗藥品常見溫度儲存條件有室溫:攝氏15至25度,和冷藏:攝氏2至8度。為達成恆定室溫,臨床試驗藥局可利用中央空調恆溫或使用室溫恆溫櫃。中央空調恆溫方式須注意臨床試驗藥局位置是否處於風管末端。若因出風量不穩定致使溫度控制困難,可加裝獨立風機強化出風量,或是採用室溫恆溫櫃。室溫恆溫櫃之溫度調控方式仰賴內部微電腦、繼電器等關鍵零組件之品質。為避免規格與使用狀況不符,建議採購前可先請設備廠商配合測試設備穩定性一段時間。維持恆定冷藏溫度則可採用具雙壓縮機之冷藏櫃,避免因單一壓縮機故障導致儲存溫度超溫之情況。另外,冷藏櫃儲存容量建議不要超過標示容積的八成,避免因出風口阻塞結冰,導致壓縮機故障。冷藏櫃每年至少須由合格廠商保養維護一次,確保其功能正常運作。
四、可設定記錄時間的連續溫濕度記
如何證明臨床試驗藥局溫度維持恆定亦相當重要。因臨床試驗藥局溫度記錄報告時間應自試驗藥品入庫臨床試驗藥局到退回試驗廠商倉儲為止,故可選擇合適的連續溫濕度記錄器,以輸出連續溫濕度記錄圖表,並歸檔於各試驗之pharmacy
binder裡。連續溫濕度記錄器應具有小體積、便攜性、與可被校正等特性,方可應用於各情況,例如:試驗藥品於兩地點之運送過程溫度記錄。此外,各臨床試驗要求溫濕度記錄時間的方式可能不同,選擇可設定記錄時間間距的連續溫濕度記錄器,統一設定最小記錄時間間距,一次滿足所有臨床試驗對於溫度記錄的條件較便利。連續溫濕度記錄器每年至少須由合格實驗室進行校正一次,確保允差值在正負攝氏0.5度的範圍內。
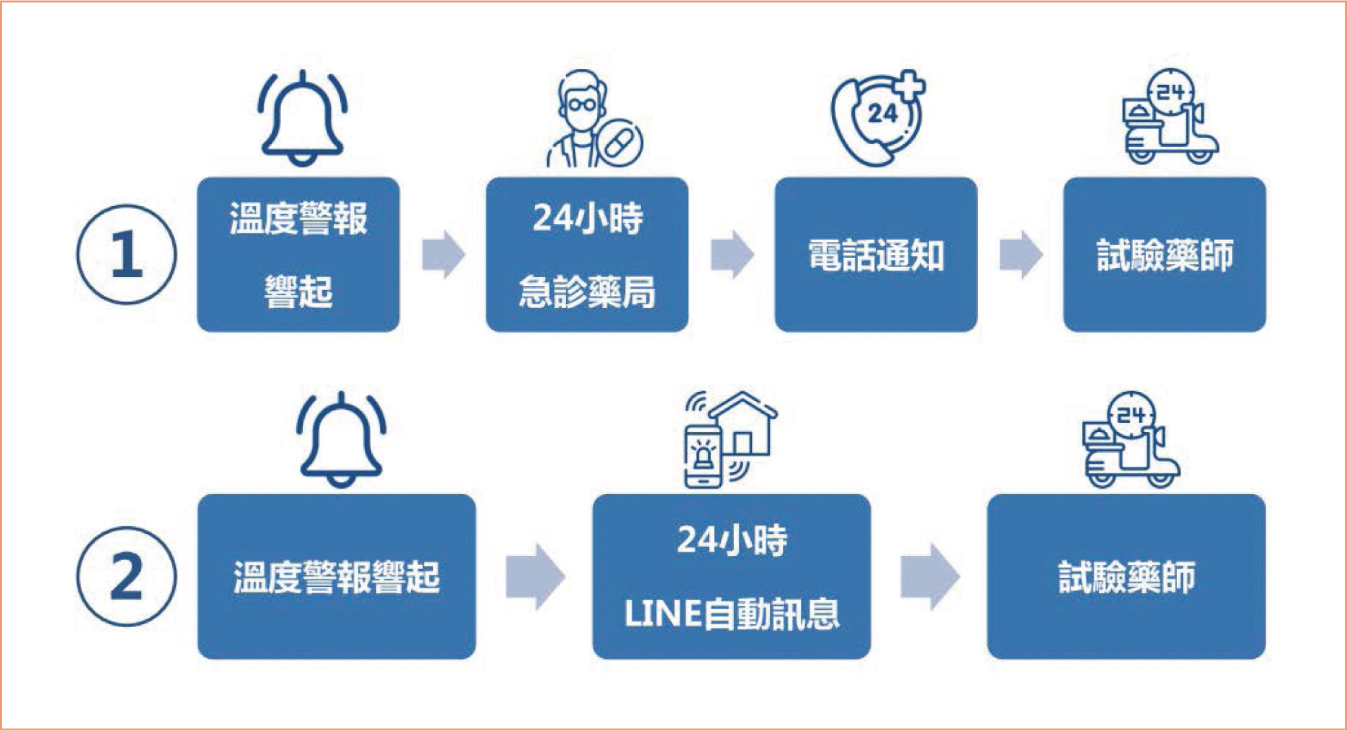
五、溫度異常警報器
值班時段藥局溫度異常警報通報順序通常以急診藥局為主,若急診藥局因忙碌或其他因素無暇通報試驗藥師,便可能耽誤臨床試驗藥局黃金搶修時機。在科技化的時代,建議可採雙軌並行機制,除了在急診藥局設置中央警報系統外,亦可在臨床試驗藥局增設4G
LINE警報系統,依溫度與持續時間設置警報訊息發送條件。4G
LINE警報系統可簡化溫度異常警報通報流程,提高試驗藥師即時處理試驗藥局溫度異常的效率。透過LINE
APP,4G
LINE警報系統可自動直接發送訊息至試驗藥師手機,試驗藥師可即時得知臨床試驗藥局溫度異常狀況與持續時間。若警報解除,該系統亦會發送警報解除訊息予試驗藥師。
圖一臨床試驗藥局溫度異常警報通報機制
六、備援方案
臨床試驗藥局所有用電設備,如恆溫櫃、冷藏櫃、溫度異常警報器等,須連接不斷電系統或緊急電源,避免功能失效。若臨床試驗藥局溫度異常狀況短時間無法解除,可用藥局其他備援可上鎖空間或冷藏櫃暫時儲存試驗藥品,並配置連續溫濕度記錄器以監測臨時儲存溫度。備援冷藏櫃也須有定期維護保養的記錄。待試驗藥局溫度恆定功能回復正常,再將試驗藥品移至臨床試驗藥局存放。
參、試驗用藥服務與管理
試驗藥師應被主持人授權執行試驗藥品管理相關工作,參與臨床試驗相關訓練,並隨時更新試驗相關資訊,以隨機應變試驗執行期間可能發生的狀況。試驗藥師應每年接受臨床試驗與受試者保護相關繼續教育,定期更新GCP(Good
Clinical Practice)學分。
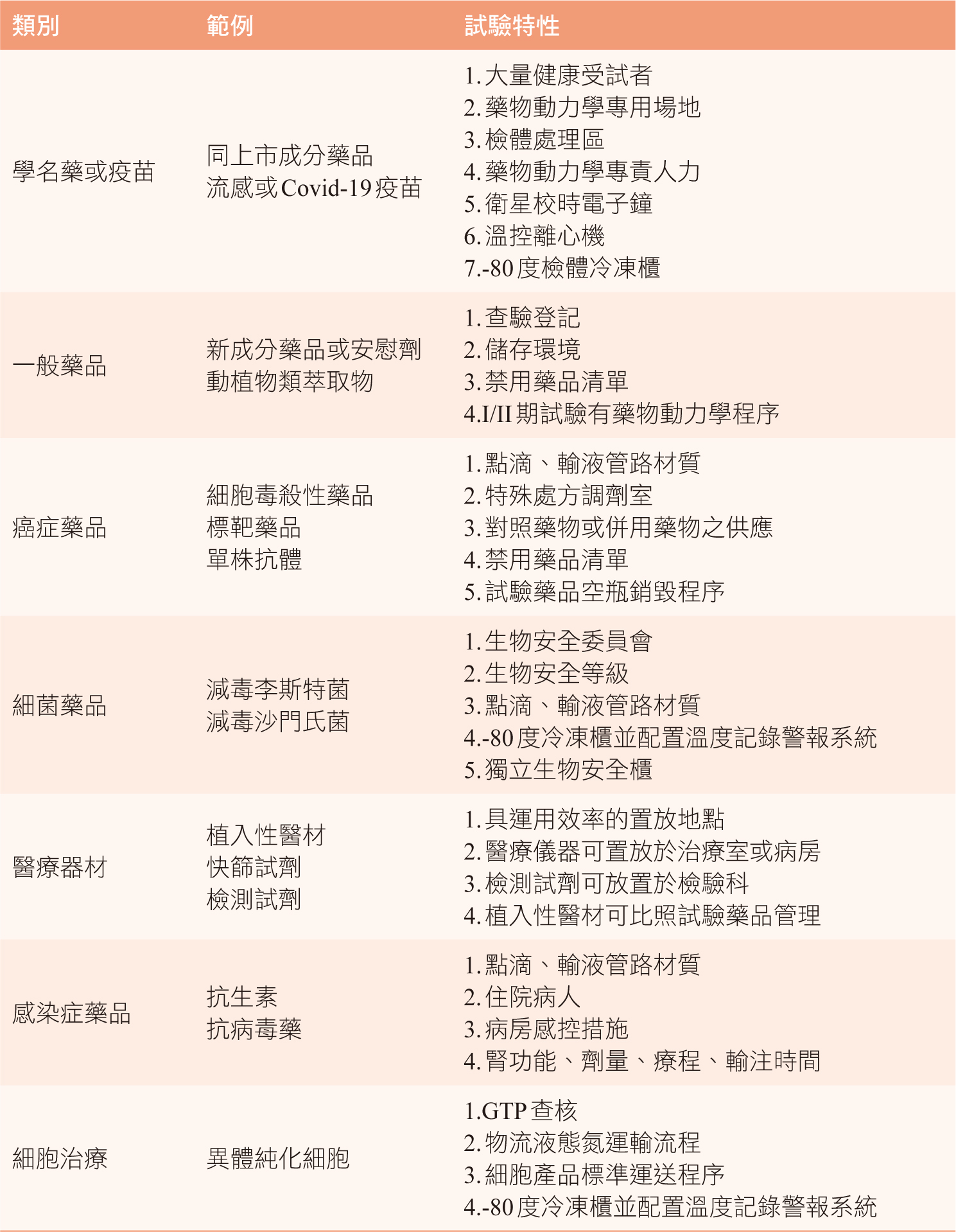
一、試驗藥品類型
試驗藥品種類繁多,以下就本院承接過的臨床試驗類型整理於下表(表二)。並依類型列舉試驗藥品範例,以及依試驗特性須具備之設備、功能、與作業要點等。
二、藥局訓練
藥局訓練(pharmacy
training)為試驗藥師工作內容中最重要的一個環節。試驗藥師須依試驗設計決定試驗藥品建檔型式、禁用藥物、庫存、配製方式、調劑與發放、回收與銷毀等流程,學習操作受試者與試驗藥品管理系統(Interactive
Response Technology, IRT),並蒐集試驗相關文件建立pharmacy
binder5。臨床試驗執行程序繁瑣且複雜,尤其在受試者篩選日(返診編號通常為baseline或是visit
1),主持人與試驗協調師通常十分忙碌,此時也是最容易發生處方錯誤的時候。故試驗藥師可訂定目標:讓主持人與試驗協調師開立處方與領藥時有防呆與除錯的能力。試驗藥師可預先設立臨床試驗專用處方箋格式,條列試驗藥品用法,並將配製方式、使用時間、調劑、發放、回收、數量等注意事項註記於專用處方箋上,作為與主持人、試驗協調師即時溝通的橋梁。某些試驗藥品配製完成後有使用時間限制,試驗藥師必須與試驗協調師盡可能在納入第一位受試者前模擬並演練收案程序。
三、試驗藥品基本檔建立
依不同的試驗設計,試驗藥品名稱於醫院藥品資訊系統的建立方式也不同。雙盲且對照組為安慰劑之試驗:建立一個無法識別試驗藥品或安慰劑的基本檔;開放標記且有對照組之試驗:建立兩個可識別試驗藥品或對照藥的基本檔;雙盲雙模擬且有安慰劑之試驗:建立兩個無法識別試驗藥品或安慰劑的基本檔。接著設立開立處方醫師權限,限定試驗藥品僅能由登錄在IRB核准函上之醫師開立,避免非試驗醫師誤開立試驗藥品處方。再來將計畫書規定的禁用藥品建檔至臨床試驗禁用藥品系統,避免受試者於試驗執行期間誤用禁用藥品導致試驗偏差。最後預先設立臨床試驗專用處方箋格式,加註依藥局手冊(pharmacy
manual)制定之標準調劑程序與相關提示訊息等。
四、試驗藥局進貨、發放、回收、銷毀流程6
完成藥局訓練後,試驗藥品會在近期內送達至臨床試驗藥局。試驗藥師於進貨時須先拆箱,將內含之溫度記錄器暫停,並輸出物流期間溫度記錄報告,再登錄該批試驗藥品資料於IRT系統,確保使用狀態為可用。若發生溫度異常,則依藥局訓練內容通報試驗委託者。完成進貨程序後,試驗藥師須通知主持人與試驗協調師開始收案。當納入受試者且主持人開立試驗處方時,試驗協調師須持IRT產出的受試者與試驗藥品資訊、門診處方箋、與臨床試驗專用處方箋向試驗藥師領取試驗藥品。若三者間內容無法相互比對成功,即代表有潛在處方錯誤的可能,試驗藥師須即時提出用藥建議。試驗藥品發放對象應為試驗協調師,不建議直接發放試驗藥品予受試者。原因在於若受試者尚有試驗項目未完成,或者試驗協調師尚未對受試者衛教配合試驗的注意事項,受試者逕自離去可能造成試驗偏差。故建議試驗藥師將簡單的衛教內容標示於藥袋或是標籤上,於試驗協調師一同進行衛教。另外,務必告知受試者於下次返診時將剩餘的試驗藥品、空瓶和包裝繳回給試驗協調師,由試驗協調師再送至臨床試驗藥局,並與試驗藥師進行點交,等待臨床試驗專員(Clinical
Research Associate, CRA)回收已用過之試驗藥品。若試驗藥品將在臨床試驗藥局進行銷毀,務必取得CRA的授權或於pharmacy
manual載明銷毀程序。上述每個階段均要有文件記錄並歸檔於pharmacy binder中。
肆、結論
醫院執行臨床試驗的成敗主要仰賴主持人、試驗協調師、試驗藥師三方的合作與溝通。試驗藥品須依試驗設計與計畫書規定的用法使用,且相關注意事項繁多。試驗藥師在完成藥局訓練後,可主動歸納試驗藥品用法,提示主持人開立試驗處方的方式,降低錯誤處方的機率,並藉由完善的資訊系統降低使用禁用藥品的機率。同時與試驗協調師合作完成受試者用藥、衛教、回收藥品等事項,建立試驗藥品專屬之綠色通道。有助於降低試驗偏差的發生,並提升試驗執行品質。
The Management of Investigational
Drug Service
Chang-Ming Chen1, Hsiu-Yen Wang2,
Hsiu-Chen Chang2, Wei-Ling Yang2
1Department of Pharmacy, Taipei
Municipal Wanfang Hospital
2Clinical Trial and Research Center,
Taipei Municipal Wanfang Hospital
Abstract
The primary goal of investigational drug
services (IDS) provided by clinical research
pharmacists is to support clinical trials are
executed in a safe, effective, and efficient
manner. The establishment of a fully functional
clinical research pharmacy in a hospital will
help clinical research pharmacists manage
investigational drug products appropriately. It
can also attract pharmaceutical or biotechnology
companies to choose the hospital as a study site
to execute clinical trials. IDS must provide
constant temperature monitoring of
investigational drug storage conditions to avoid
temperature excursions with a specific
procedure. At the same time, clinical research
pharmacists must maintain the medication safety
of subjects and establish a set of standard
operating procedures to reduce the occurrence of
medication errors. This article aims to
introduce how to establish a clinical research
pharmacy and provide practical experience in the
management of IDS.
參考資料:
1. Stolar MH, Gabriel T, Grant KL, et al:
Pharmacy-coordinated investigational drug
services. Am J Hosp Pharm. 1982;39(3):232-6.
2. Shehab N, Tamer H: Dispensing investigational
drugs: regulatory issues and the role of the
investigational drug service. Am J Health Syst
Pharm. 2004;61(18):1882-4.
3. Kay SC, Luke DG, Tamer HR: ASHP Guidelines
for the Management of Investigational Drug
Products. Am J Health Syst Pharm.
2018;75(8):561-573.
4. Pierson JF, Kirchoff MC, Tyee RT, et al:
Establishment of a research pharmacy to support
Ebola clinical research in Liberia. J Am Pharm
Assoc (2003). 2017;57(4):542-546.
5. 藥品優良臨床試驗作業準則,2020。
6. ASHP guidelines on clinical drug research.
American Society of Health-System Pharmacists.
Am J Health Syst Pharm. 1998;55(4):369-75.
通訊作者:陳昶名/電子信箱:craloxav@gmail.com